
【题目】下列反应的离子方程式书写正确的是
A. 金属钠投入到足量的稀盐酸中: Na+2H+==Na++H2↑
B. CuO溶解在稀盐酸中:O2-+2H+==H2O
C. 氢氧化钡溶液与稀硫酸反应:Ba2++SO![]() +H++OH-== BaSO4↓+H2O
+H++OH-== BaSO4↓+H2O
D. 碳酸氢钙溶液与稀盐酸反应:HCO![]() +H+==H2O+CO2↑
+H+==H2O+CO2↑
【答案】D
【解析】A项,电荷不守恒;B项,CuO应以化学式保留;C项,不符合量的比例;D项,碳酸氢钙与稀盐酸反应生成CaCl2、H2O和CO2。
A项,电荷不守恒,正确的离子方程式为2Na+2H+=2Na++H2↑,A项错误;B项,CuO应以化学式保留,正确的离子方程式为CuO+2H+=Cu2++H2O,B项错误;C项,Ba(OH)2溶液与稀硫酸反应的化学方程式为Ba(OH)2+H2SO4=BaSO4↓+2H2O,正确的离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,C项错误;D项,碳酸氢钙与稀盐酸反应生成CaCl2、H2O和CO2,反应的离子方程式为HCO3-+H+=H2O+CO2↑,D项正确;答案选D。


科目:高中化学 来源: 题型:
【题目】中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。关于![]() Lv 的叙述错误的是
Lv 的叙述错误的是
A. 原子序数 116B. 中子数 177
C. 核外电子数 116D. 核电荷数 293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)海洋是一座巨大的化学资源宝库,从中可以提取许多常见的化学物质,结合所学知识回答下列问题,
(1)“吹出法”提溴空气吹出法是工业规模提溴的常用方法,其流程如下:
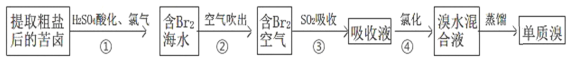
其中步骤②~④的目的是________________________________________________。步骤③反应的离子方程式为_______________________________。除SO2外,步骤③还可以选用Na2CO3溶液吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收1molBr2时,转移电子的物质的量为____________mol。
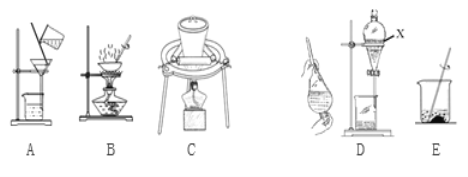
(2)实验室模拟从海带中提取碘,可能经历如下操作(或过程),请选择必要的操作(或过程),并按实验的先后顺序排列___________________________(填写编号)
(3)卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子。现以卤块为原料按下图流程制备轻质氧化镁,若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,回答下列问题:

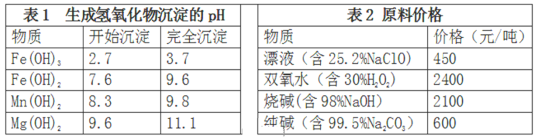
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去。
步骤①反应的离子方程式为:_____________________________________;
步骤②的反应方程式为:_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在试管Ⅰ和Ⅱ中分别加入3mL稀盐酸(均足量),再将装有0.3gNaHCO3和0.3gNa2CO3粉末的小气球分别套在Ⅰ和Ⅱ的管口。各将气球内的NaHCO3、Na2CO3同时倒入试管中,回答:
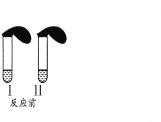
①I试管发生的离子方程式: _______________________;
②两支试管中充分反应后生成的气体总量Ⅰ_____Ⅱ,反应结束时消耗盐酸的物质的量Ⅰ_____Ⅱ(填“>”“=”或“<”)。
(2)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度升高。由此他得出:不管其状态如何,NaHCO3和盐酸反应为吸热反应,而Na2CO3和盐酸反应为放热反应。乙同学认为甲同学的判断太武断,继续进行了下列实验(每次实验各做3次平行实验,取平均值):
序号 | 试剂1 | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
1 | 50mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
2 | 50mL水 | 3.2gNa2CO3固体 | 20℃ | 24.3℃ |
3 | 35mL稀盐酸 | 含2.5gNaHCO3的饱和溶液15mL | 20℃ | 18.8℃ |
4 | 35mL稀盐酸 | 含3.2gNa2CO3饱和溶液15mL[来 | 20℃ | 24.2℃ |
5 | 50mL稀盐酸 | 2.5gNaHCO3固体 | 20℃ | T℃ |
6 | 50mL稀盐酸 | 3.2gNa2CO3固体 | 20℃ | 25.1℃ |
通过上述实验可得出:
①Na2CO3的饱和溶液和盐酸的反应是___________(吸热或放热)反应;
②NaHCO3的饱和溶液和盐酸的反应是__________(吸热或放热)反应;
③表中⑤号试验混合后温度T℃可能是(填编号)_________________________。
A.18.5℃ B. 24.2℃ C.16.2℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充足搅拌、过滤。
(1)往滤渣中加入过量 NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是_________________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察的现象是__________________。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO![]() 沉淀质量,以确定碳酸钙的质量分数。
沉淀质量,以确定碳酸钙的质量分数。
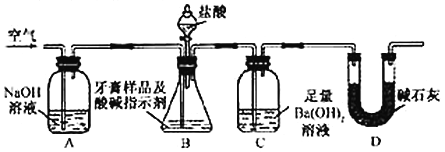
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:________________________。
(4)C中反应生成沉淀的离子方程式是__________________。
(5)下列各项措施中,不能提高测定准确度的是_________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取10.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为__________。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,另含少量杂质FeCO3和SiO2等)为原料制备高纯氧化镁的实验流程如下:
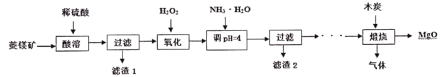
(1)MgCO3与稀硫酸反应的离子方程式是____________。
(2)加入H2O2氧化时,发生反应的离子方程式为____________________。
(3)煅烧过程存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。
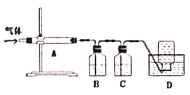
①A中现象是________,A中收集的物质可用热的NaOH溶液去除,写出该反应的化学反应方程式:__________________。
②B中盛放的溶液可以是_________(填字母)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.品红溶液 e.酸性KMnO4溶液
③D中收集的气体可以是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是一种利用微生物将有机物中的化学能直接转化成电能的装置。如图是一种微生物燃料电池的工作原理示意图,下列有关说法不正确的是
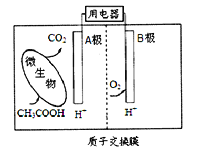
A. B电极是正极
B. 电池内H+从左侧向右侧迁移
C. A电极的电极反应式: CH3COOH + 8e-+ 2H2O=2CO2 +8H+
D. 该电池可利用有机废水等有机废弃物作为燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表前四周期的一部分,下列关于元素X、Y、Z、W的说法正确的是( )
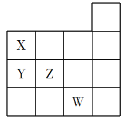
①X、Y的最高价氧化物对应水化物的酸性:Y<X
②Y、Z的气态氢化物的稳定性:Y<Z
③W的单质是常温下唯一的液态非金属,与铁粉反应可以生成Fe3+
④W的原子序数比Z大19
A. ①B. ①②
C. ①②③D. ①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com