
【题目】下列有关说法正确的是
A.图所示装置可构成铜-锌原电池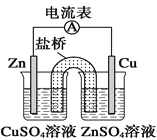
B.图是HI(g)分解能量与反应进程关系曲线,a、b中I2依次为固态、气态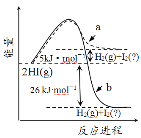
C.图所示装置可以实现电解精炼铝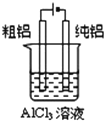
D.图实验设计可用于探究催化剂Fe3+、Cu2+对过氧化氢分解速率的影响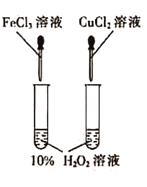
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列溶液中Cl-的物质的量浓度最大的是
A. 150 mL1 mol/L NaCl溶液 B. 50 mL2mol/L NH4Cl溶液
C. 150 mL 0.5 mol/L CaCl2溶液 D. 50 mL l mol/L AlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有未知浓度的盐酸25 mL,能跟20 mL某浓度的氢氧化钠溶液完全反应。若先用0.1 g 碳酸钙与25 mL这种酸作用,剩余的酸需用上述氢氧化钠溶液4 mL才能中和。求盐酸和氢氧化钠溶液中溶质的物质的量浓度分别是多少?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生需要用烧碱固体配制1 molL﹣1的NaOH溶液450 mL。请回答下列问题:
(1)计算:需要称取NaOH固体__g。
(2)配制时,必须使用的仪器有托盘天平(带砝码)、药匙、烧杯、玻璃棒、量简,还缺少的仪器是__、__。(填仪器名称)
(3)在使用容量瓶前必须进行的一步操作是__。
(4)实验两次用到玻璃棒,其作用分别是:先用于__、后用于__。
(5)若出现如下情况,其中将引起所配溶液浓度偏高的是__(填字母)。
A.容量瓶实验前用蒸馏水洗干净,但未烘干
B.天平砝码生锈
C.配制过程中遗漏了洗涤步骤
D.未冷却到室温就注入容量瓶
E.加蒸馏水时不慎超过了刻度线
F.定容观察液面时俯视
(6)若实验过程中出现(5)中D这种情况你将如何处理?__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn,发生反应:Sn(s)+Pb2+(aq)![]() Sn2+(aq)+Pb(s),体系中c(Pb2+)、c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)、c(Sn2+)变化关系如图所示。下列判断正确的是( )
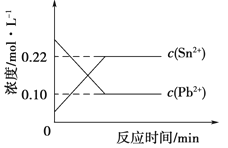
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应正反应是吸热反应
D.25℃时,该反应的平衡常数K=2.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO(甲醛)与O2在羟基磷灰石(HAP)表面催化生成H2O的历程,该历程示意图如下(图中只画出了 HAP的部分结构):
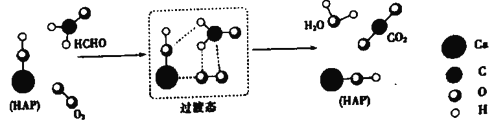
下列说法不正确的是
A. HAP能提高HCHO与O2的反应速率
B. HCHO在反应过程中,有C-H键发生断裂
C. 根据图示信息,CO2分子中的氧原子全部来自O2
D. 该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题
(1)某蓄电池的正负极标志难以辨别,请设计实验方案,将蓄电池的正负极辨别出来____________________。
(2)解释下列化学反应的反应速率变化关系曲线
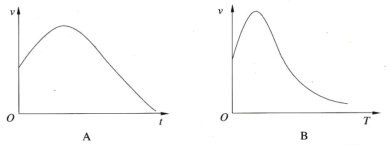
①将除去氧化膜的镁条投入盛有稀盐酸的试管中,产生氢气的速率随时间的变化关系如图A所示,试解释原因:_________________________________________________________。
②过氧化氢在酶的催化作用下的分解速率随温度的变化关系如图B所示,试解释原因:______________________。
(3)氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。
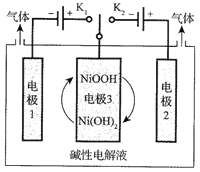
①制H2时,连接_______________。
②改变开关连接方式,可得O2,电极反应式为___________________________。
③结合①和②中电极3的电极反应式,说明电极3的作用:______________________________。
(4)甲醇燃料电池DMFC可作电脑、汽车的能量来源。在实验室完成一个实验,用DMFC电解NaClO3溶液可制取NaClO4溶液,装置如图所示(其中DMFC以KOH作电解质)。
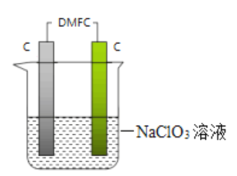
①写出电源负极电极反应式:______________________________。
②写出电解的总反应化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验发现,298 K时,在氯化铁酸性溶液中加少量锌粒后,Fe3+立即被还原成Fe2+。某夏令营兴趣小组根据该实验事实设计了如图所示原电池装置。下列有关说法正确的是

A. 该原电池的正极反应是:Zn-2e-=Zn2+
B. 左烧杯中溶液的红色逐渐褪去
C. 该电池铂电极上立即有气泡出现
D. 该电池总反应为:3Zn+2Fe3+=2Fe+3Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2分别通入无氧、有氧的浓度均为0.1 mol·L-1的 BaCl2溶液和Ba(NO3)2溶液中,探究体系中微粒间的相互作用,实验记录如下:
实验记录 | |
pH变化 |
|
溶液中是否产生沉淀 | BaCl2溶液(无氧)中无白色沉淀、BaCl2溶液(有氧)中有白色沉淀 Ba(NO3)2溶液(无氧)中有白色沉淀、Ba(NO3)2溶液(有氧)中有白色沉淀 |
下列说法不正确的是
A.曲线a 所示溶液pH降低的原因:SO2 + H2O![]() H2SO3
H2SO3![]() H+ + HSO3-
H+ + HSO3-
B.曲线c 所示溶液中发生反应:2Ba2+ + O2 + 2SO2 + 2H2O =2BaSO4↓+ 4H+
C.与曲线a、b、c对比,可知曲线d所表示的过程中NO3-是氧化SO2的主要微粒
D.依据该实验预测0.2 mol·L-1的KNO3溶液(无氧)也可以氧化SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com