
【题目】下列说法正确的是![]()
A.向50mL![]() 的盐酸中加入烧碱后,水的
的盐酸中加入烧碱后,水的![]() 不变
不变
B.![]() 和
和![]() 混合液中,二者对对方的平衡都起了抑制作用
混合液中,二者对对方的平衡都起了抑制作用
C.室温时某溶液的![]() ,则该物质一定是酸或强酸弱碱盐
,则该物质一定是酸或强酸弱碱盐
D.常温下![]()
![]() 的HA溶液中
的HA溶液中 ,则
,则![]()
![]() 溶液中
溶液中![]()
![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铬及其化合物常被应用于冶金、化工、电镀、制药、纺织等行业,但使用后的废水因其中含高价铬的化合物而毒性很强,必须进行处理。工业上往往采取下列循环工艺防止铬的污染:
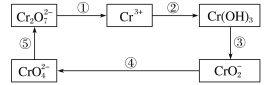
(1)上述各步反应中属于氧化还原反应的是__________(填序号)。
(2)第①步,含![]() 的废水在酸性条件下用绿矾FeSO4·7H2O处理,写出该反应的离子方程式:_________。
的废水在酸性条件下用绿矾FeSO4·7H2O处理,写出该反应的离子方程式:_________。
(3)第②步,向上述反应后的溶液中加入适量的碱石灰,使铬离子转变为Cr(OH)3沉淀。处理后,沉淀物中除了Cr(OH)3外,还有_____、____(写化学式)。已知Cr(OH)3性质类似Al(OH)3,是既能与强酸反应又能与强碱反应的两性物质,从沉淀中分离出Cr(OH)3的流程如图:
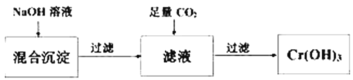
写出从该沉淀物中分离出Cr(OH)3的离子方程式__________、____________。
(4)回收所得的Cr(OH)3,经③④⑤步处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:
①![]() +6I-+14H+=3I2+2Cr3++7H2O
+6I-+14H+=3I2+2Cr3++7H2O
②2![]() +I2=
+I2=![]() +2I-
+2I-
准确称取纯净的K2Cr2O7 0.1225g配成溶液,用上述方法滴定,消耗Na2S2O3溶液25.00mL。则Na2S2O3溶液的物质的量浓度为______(保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水溶液中c(H+)与c(OH-)的变化关系如图中曲线a c所示,下列判断错误的是
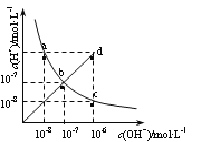
A.a c曲线上的任意一点都有c(H+)·c(OH-)=10-14
B.b d线段上任意一点对应的溶液都呈中性
C.d点对应溶液的温度高于25℃,pH<7
D.CH3COONa溶液不可能位于c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2经一系列反应可以得到硫酸和芒硝(Na2SO4·10H2O),其转化关系如图:

(1)SO2可用于H2SO4。已知25℃、101kPa 时:
2SO2(g)+O2(g)+2H2O(l) = 2H2SO4(l) ΔH1=-456kJ/mol
SO3(g)+H2O(l)=H2SO4(l) ΔH2=-130kJ/mol
则I中SO2(g)→SO3(g)的热化学方程式是_____。
(2)若Ⅲ中将SO2通入NaHCO3溶液中,反应的离子反应方程式是_____。已知:25℃时,H2CO3电离平衡常数:K1=4.3×10-7K2=5.6×10-11;H2SO3电离平衡常数:K1=1.5×10-2K2=6.0×10-8
(3)若Ⅲ中将SO2通入NaOH 溶液中,得到NaHSO3溶液,用化学用语表示NaHSO3在水溶液中存在的可逆过程_____。25℃时,SO2与NaOH溶液反应后的溶液中,含硫各微粒(H2SO3、![]() 和
和![]() )的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是_____(填字母)。
)的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是_____(填字母)。

A.为获得更多的NaHSO3,应将溶液的 pH 控制在 4~5
B.pH=3 时,溶液中 c(![]() )>c(H2SO3)> c(
)>c(H2SO3)> c(![]() )
)
C.由 M 点坐标,可以计算H2SO3H++![]() 的电离常数
的电离常数
D.pH=9 时,溶液中存在c(H+)=c(![]() )+2c(
)+2c(![]() )+c(OH-)
)+c(OH-)
(4)通过电解法可分离NaHSO3与Na2SO3混合物,如图所示,结合化学用语解释 c 室只排出Na2SO3的原因_____。

(5)步骤 IV 中可以将NaHSO3转化为Na2SO4的试剂是_____,_____(任意写两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.2 mol·L-1的HX溶液中c(HX):c(X-)=99:1,下列说法正确的是
A.升温至 30℃时,溶液 c(HX):c(X)=99:1B.25℃时K(HX)≈2×l0-5
C.向溶液中加入适量NaX溶液,酸的电离平衡向左移动,新平衡时c(X-)减小D.加水稀释后,溶液中c(X-)、c(H+)、c(OH-)均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.20 | |
t2 | 0.80 |
依据题意回答下列问题:
(1)反应在t1 min内的平均速率为v(H2)=________ mol·L-1·min-1。
(2)保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,到达平衡时,n(CO2)=________mol。
(3)温度升至800 ℃,上述反应的平衡常数为0.64,则正反应为________反应(填“放热”或“吸热”)。
(4)700 ℃时,向容积为2 L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20 mol、2.00 mol、1.20 mol、1.20 mol,则此时该反应v(正)________v(逆)(填“>”“<”或“=”)。
(5)该反应在t1时刻达到平衡,在t2时刻因改变某个条件,CO和CO2浓度发生变化的情况如图所示。图中t2时刻发生改变的条件可能是________或________。
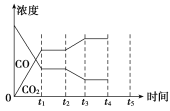
(6)若该容器容积不变,能说明反应达到平衡的是________。
①c(CO)与c(H2)的比值保持不变
②v(CO2)正=v(H2O)逆
③体系的压强不再发生变化
④混合气体的密度不变
⑤体系的温度不再发生变化
⑥气体的平均相对分子质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下:

则下列说法错误的是
A. 生成CH3COOH总反应是化合反应
B. ①→②过程形成了C―C键
C. CH4→CH3COOH过程中,有C―H键发生断裂
D. ①→②吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2A为二元弱酸,25 ℃时,用Na2A溶液吸收H2A,且最终吸收H2A的量小于原溶液中Na2A的物质的量,其吸收液pH随![]() 变化的关系如图所示,以下说法不正确的是
变化的关系如图所示,以下说法不正确的是

A.向Na2A溶液加入H2A过程中,水电离的c(OH-)不断增大
B.NaHA溶液中:c(H+)>c(OH-)
C.H2A的第二步电离常数的数量级为10-8
D.当吸收液呈中性时:c(Na+)=2c(A2-)+c(HA-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应IO3-+5I-+6H+![]() 3I2+3H2O设计成如下图所示的原电池。开始时向甲烧杯中加入少量浓硫酸,电流表指针发生偏转,一段时间后,电流表指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流表指针再次发生偏转。下列判断不正确的是
3I2+3H2O设计成如下图所示的原电池。开始时向甲烧杯中加入少量浓硫酸,电流表指针发生偏转,一段时间后,电流表指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流表指针再次发生偏转。下列判断不正确的是

A. 开始加入少量浓硫酸时,乙中石墨电极上发生氧化反应
B. 开始加入少量浓硫酸时,同时在甲、乙烧杯中都加入淀粉溶液,只有乙烧杯中溶液变蓝
C. 电流表读数为零时,反应达到化学平衡状态
D. 两次电流表指针偏转方向相反
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com