
【题目】SO2经一系列反应可以得到硫酸和芒硝(Na2SO4·10H2O),其转化关系如图:

(1)SO2可用于H2SO4。已知25℃、101kPa 时:
2SO2(g)+O2(g)+2H2O(l) = 2H2SO4(l) ΔH1=-456kJ/mol
SO3(g)+H2O(l)=H2SO4(l) ΔH2=-130kJ/mol
则I中SO2(g)→SO3(g)的热化学方程式是_____。
(2)若Ⅲ中将SO2通入NaHCO3溶液中,反应的离子反应方程式是_____。已知:25℃时,H2CO3电离平衡常数:K1=4.3×10-7K2=5.6×10-11;H2SO3电离平衡常数:K1=1.5×10-2K2=6.0×10-8
(3)若Ⅲ中将SO2通入NaOH 溶液中,得到NaHSO3溶液,用化学用语表示NaHSO3在水溶液中存在的可逆过程_____。25℃时,SO2与NaOH溶液反应后的溶液中,含硫各微粒(H2SO3、![]() 和
和![]() )的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是_____(填字母)。
)的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是_____(填字母)。

A.为获得更多的NaHSO3,应将溶液的 pH 控制在 4~5
B.pH=3 时,溶液中 c(![]() )>c(H2SO3)> c(
)>c(H2SO3)> c(![]() )
)
C.由 M 点坐标,可以计算H2SO3H++![]() 的电离常数
的电离常数
D.pH=9 时,溶液中存在c(H+)=c(![]() )+2c(
)+2c(![]() )+c(OH-)
)+c(OH-)
(4)通过电解法可分离NaHSO3与Na2SO3混合物,如图所示,结合化学用语解释 c 室只排出Na2SO3的原因_____。

(5)步骤 IV 中可以将NaHSO3转化为Na2SO4的试剂是_____,_____(任意写两种)。
【答案】2SO2(g)+O2(g)=2SO3(g) ΔH=-196kJ/mol SO2+![]() =
=![]() +CO2
+CO2 ![]() +H2OH2SO3+ OH-,
+H2OH2SO3+ OH-,![]()
![]() + H+ D 2H++e-=H2,H+浓度降低,使
+ H+ D 2H++e-=H2,H+浓度降低,使![]()
![]() + H+平衡正向移动,Na+通过离子交换膜进入c室,最终生成Na2SO3 H2O2 Cl2
+ H+平衡正向移动,Na+通过离子交换膜进入c室,最终生成Na2SO3 H2O2 Cl2
【解析】
根据题给的热化学方程式由盖斯定律求出;根据题给的电离常数判断酸性强弱,写出正确的离子方程式;根据NaHSO3,判断溶液中存在电离和水解平衡;由题中所给的图示信息,判断溶液中离子浓度相对大小及相关计算;根据题中图示信息,写出阳极、阴极电极反应,由阳离子交换分离NaHSO3与Na2SO3混合物;根据氧化还原反应,由化合价判断需加入氧化剂。
(1)①2SO2(g)+O2(g)+2H2O(l) = 2H2SO4(l) ΔH1=-456kJ/mol,②SO3(g)+H2O(l)=H2SO4(l) ΔH2=-130kJ/mol,由盖斯定律计算①-②×2得2SO2(g)+O2(g)=2SO3(g) ΔH=ΔH1-ΔH2×2=(-456kJ/mol)-(-130kJ/mol)×2=-196 kJ/mol;答案为2SO2(g)+O2(g)=2SO3(g) ΔH=-196 kJ/mol。
(2)由H2CO3电离平衡常数:K1=4.3×10-7K2=5.6×10-11;H2SO3电离平衡常数:K1=1.5×10-2K2=6.0×10-8可知,亚硫酸的酸性比碳酸强,但亚硫酸氢根的酸性比碳酸的弱,因而根据强酸制弱酸的原理,SO2通入NaHCO3溶液中发生反应,生成亚硫酸氢根和二氧化碳,其离子反应方程式为SO2+![]() =
=![]() +CO2;答案为SO2+
+CO2;答案为SO2+![]() =
=![]() +CO2。
+CO2。
(3)NaHSO3溶液中,HSO3-在溶液中存在电离平衡:HSO3-SO32-+span>H+,HSO3-在溶液中还存在水解平衡:HSO3-+H2OH2SO3+OH-;答案为HSO3-SO32-+H+,HSO3-+H2OH2SO3+OH-。
A.图象可知,为获得尽可能纯的NaHSO3,可将溶液的pH控制在45左右,故A正确;
B.由图象可知,pH=3时,溶液中c(![]() )>c(H2SO3),SO32-几乎没有,浓度顺序为c(
)>c(H2SO3),SO32-几乎没有,浓度顺序为c(![]() )>c(H2SO3)>c(
)>c(H2SO3)>c(![]() ),故B正确;
),故B正确;
C.根据M(1.9,0.5)坐标可知,pH=1.9,X(i)=0.5,即c(H2SO3)= c(![]() ),则由H2SO3H++
),则由H2SO3H++![]() 反应,其电离常数K1=
反应,其电离常数K1=![]() =10-1.9,故C正确;
=10-1.9,故C正确;
D.pH=9时,溶液中存在Na+、H+、HSO3-、SO32-、OH-,由电荷守恒得出c(Na+)+c(H+)=c(![]() )+2c(
)+2c(![]() )+c(OH-),故D错误;
)+c(OH-),故D错误;
答案为D。
(4)通过电解法可分离NaHSO3与Na2SO3混合物,阳极4OH--4e-=O2↑+2H2O,c(OH-)降低,促进水电离,c(H+)增大,多余的H+由a室经阳离子交换膜进入b室,H+与SO32-结合生成HSO3-,Na2SO3转化为NaHSO3,阴极2H++2e-=H2↑,导致HSO3-H++SO32-正向移动,生成更多SO32-,Na+从b室进入c室,NaHSO3转化为Na2SO3,实现Na2SO3的循环利用,最终b中Na2SO3转化为NaHSO3,c中NaHSO3转化为Na2SO3,实现分离;答案为:阴极2H++2e-=H2↑,导致平衡HSO3-H++SO32-向右移动,生成更多SO32-,Na+从b室进入c室,c中NaHSO3转化为Na2SO3,实现分离。
(5) 步骤 IV 中将NaHSO3转化为Na2SO4,硫元素的化合价由+4价升高到+6价,失电子,作还原剂,因而要实现上述转化,需加入氧化剂,H2O2、Cl2等常作氧化剂,加入它们,即可实现由NaHSO3转化为Na2SO4;答案为H2O2、Cl2。


科目:高中化学 来源: 题型:
【题目】央视报道《王者归“铼”》:中国发现超级金属“铼”,飞机火箭上天全靠它,有望打破美国垄断。
(1)铼(Re)被称为类锰元素,与锰的外围电子结构数相同,已知Mn的外围电子排布式为3d54s2,写出75Re的外围电子排布式:______,其最高价氧化物的化学式为_______。
(2)铢合金可作为醇脱氢反应的催化剂:CH3OH![]() HCHO+H2↑,上述反应两种有机物中碳原子的杂化形式分别是______和_______。C、H、O三种元素中,电负性最大的是______(填元素符号)。
HCHO+H2↑,上述反应两种有机物中碳原子的杂化形式分别是______和_______。C、H、O三种元素中,电负性最大的是______(填元素符号)。
(3)实验中常用过硫酸盐氧化法测定钢铁中锰的含量,反应原理为2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+。已知H2S2O8的结构简式如图所示。
2MnO4-+10SO42-+16H+。已知H2S2O8的结构简式如图所示。
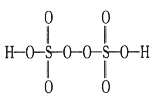
上述反应中S2O82-断裂的共价键类型为___(填“σ键”或“π键”),每生成0.3molMnO4-,过硫酸根中断裂的共价键数目为_____NA。
(4)科学家研制出一种新型的超硬材料,类似于金刚石的结构,但硬度比金刚石大,该晶体元素组成为C和N,其晶胞如图所示(图示原子都包含在晶胞内),则该晶胞所含氮原子的个数为____。已知晶胞参数分别为a nm、b nm、c nm,,该晶体的摩尔质量为Mg·mol-1,密度为ρg·cm-3,则阿伏加德罗常数的数值为___(用含a、b、c、ρ、M的代数式表示)。
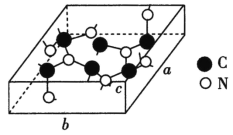
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.请回答下列问题
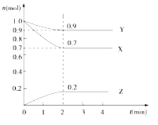
(1)由图中数据分析,该反应的化学方程式为___________________________
(2)反应开始至2min,Z的平均反应速率为________
(3)3min时,Z的生成速率与Z的消耗速率相比较,前者________(填“大于”“小于”或“等于”)后者.
(4)上述反应进行过程中,如果降低温度,则其反应速率________(填“增大”“减小”或“不变”).
(5)下列各项中不可以说明上述反应达到平衡的是________(填字母).
a.生成1molZ和同时生成1.5molX b. X、Y、Z的反应速率之比为3:2:1
c.同一物质的正反应速率等于逆反应速率 d.X的浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各溶液中微粒物质的量浓度关系不正确的是
A.pH=10 的Na2CO3 溶液:c(OH-)=c(![]() )+c(H+)+2c(H2CO3)
)+c(H+)+2c(H2CO3)
B.pH=13 的氨水与pH=1 的盐酸等体积混合:c(Cl-)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C.pH=7 的 Na2C2O4 和 NaHC2O4 混合溶液:c(Na+)=2c(![]() )+c(
)+c(![]() )
)
D.浓度均为 0.2 mol/L 的 NH4Cl 溶液与NaOH 溶液等体积混合:c(Na+)=c(Cl-)>c(OH-)>c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同温度下,水溶液中![]() 的物质的量浓度和
的物质的量浓度和![]() 的物质的量浓度的关系如图所示.下列说法不正确的是
的物质的量浓度的关系如图所示.下列说法不正确的是![]()

A.M点和N点对应的溶液均呈中性
B.![]() 时,P点对应溶液中,水电离出来的
时,P点对应溶液中,水电离出来的![]() 可能为
可能为![]() 或
或![]()
C.![]() 时,
时,![]() 的NaOH溶液与
的NaOH溶液与![]() 的稀
的稀![]() 等体积混合,所得溶液的
等体积混合,所得溶液的![]()
D.向某溶液中加入酸或碱,均可以使该溶液从M点转化为N点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究溶液的 pH 对 KI 与 O2 反应的影响,实验如下。
装置 | 烧杯中的液体 | 现象 |
| ① 2 mL 1 mol/L KI 溶液+5 滴淀粉 | 5 分钟后无明显变化 |
② 2 mL 1 mol/L KI 溶液+5 滴淀粉+2 mL 0.2 mol/L HCl 溶液 | 5 分钟后溶液变蓝 | |
③ 2 mL 1 mol/L KI 溶液+5 滴淀粉+2 mL 0.2 mol/L KCl 溶液 | 5 分钟后无明显变化 | |
④ 2 mL pH=8.5 混有 KOH 的 1 mol/L KI 溶液+5 滴淀粉 | 5 小时后溶液才略变蓝 | |
⑤ 2 mL pH=10混有KOH的1 mol/L KI 溶液+5 滴淀粉 | 5 小时后无明显变化 |
(1)实验①中无现象,可能的原因是:i.KI与O2不反应,ii._____。
(2)若放置5小时后,实验①中的溶液变蓝,则反应的离子方程式是_____。
(3)去掉实验③,对该探究过程_____(填“有”或“没有”)影响。
(4)对比实验②和实验④,可以得出的结论是_____。
(5)对于实验⑤的现象,甲同学提出猜想“pH=10时O2不能氧化 I-”,设计了下列装置进行实验⑥,验证猜想。

i.烧杯a 中的溶液为_____。
ii. 实验结果是b 中溶液变蓝,此猜想不成立。通入O2后,a中的电极反应式是_____。
iii.实验⑥的结果说明实验⑤中“无明显现象的原因”是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.向50mL![]() 的盐酸中加入烧碱后,水的
的盐酸中加入烧碱后,水的![]() 不变
不变
B.![]() 和
和![]() 混合液中,二者对对方的平衡都起了抑制作用
混合液中,二者对对方的平衡都起了抑制作用
C.室温时某溶液的![]() ,则该物质一定是酸或强酸弱碱盐
,则该物质一定是酸或强酸弱碱盐
D.常温下![]()
![]() 的HA溶液中
的HA溶液中 ,则
,则![]()
![]() 溶液中
溶液中![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 一定量的甲烷恰好与一定量的氧气完全反应后得到CO、CO2和水蒸气共30.4g,该产物缓缓通过浓硫酸充分吸收后,浓硫酸增重14.4g,则此甲烷完全燃烧还需要氧气的体积(标准状况)为
A.1.12L B.2.24L C.3.36L D.4.48L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银锌电池广泛用作各种电子仪器的电源,其电极分别为![]() 和
和![]() ,电解质溶液为
,电解质溶液为![]() 溶液,总反应式为
溶液,总反应式为![]() 。下列说法不正确的是( )。
。下列说法不正确的是( )。
A.原电池放电时,负极上发生反应的物质是![]()
B.负极的电极反应是![]()
C.工作时,负极区溶液碱性减弱,正极区溶液碱性增强
D.溶液中的![]() 向正极移动
向正极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com