
【题目】25℃时,下列各溶液中微粒物质的量浓度关系不正确的是
A.pH=10 的Na2CO3 溶液:c(OH-)=c(![]() )+c(H+)+2c(H2CO3)
)+c(H+)+2c(H2CO3)
B.pH=13 的氨水与pH=1 的盐酸等体积混合:c(Cl-)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C.pH=7 的 Na2C2O4 和 NaHC2O4 混合溶液:c(Na+)=2c(![]() )+c(
)+c(![]() )
)
D.浓度均为 0.2 mol/L 的 NH4Cl 溶液与NaOH 溶液等体积混合:c(Na+)=c(Cl-)>c(OH-)>c(![]() )
)
【答案】B
【解析】
A.根据质子守恒可知,Na2CO3 溶液:c(OH-)=c(![]() )+c(H+)+2c(H2CO3),故A正确;
)+c(H+)+2c(H2CO3),故A正确;
B.pH=13 的氨水与pH=1 的盐酸等体积混合后氨水过量,溶液呈碱性,c(![]() )>c(Cl-)>c(OH-)>c(H+),故B错误;
)>c(Cl-)>c(OH-)>c(H+),故B错误;
C.pH=7 的 Na2C2O4 和 NaHC2O4 混合溶液,根据电荷守恒得c(Na+)+ c(H+)=2c(![]() )+c(
)+c(![]() )+c(OH-),因中性溶液中c(H+)=c(OH-),则c(Na+)=2c(
)+c(OH-),因中性溶液中c(H+)=c(OH-),则c(Na+)=2c(![]() )+c(
)+c(![]() ),故C正确;
),故C正确;
D.浓度均为 0.2 mol/L 的 NH4Cl 溶液与NaOH 溶液等体积混合恰好完全反应产生等浓度的一水合氨和氯化钠,因此c(Na+)=c(Cl-),而一水合氨弱碱不完全电离,结合水的电离可知,c(OH-)>c(![]() ),故c(Na+)=c(Cl-)>c(OH-)>c(
),故c(Na+)=c(Cl-)>c(OH-)>c(![]() ),故D正确;
),故D正确;
故选:B。


科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2O(l)=H2(g)+ ![]() O2(g) △H=+285.8 kJ/mol
O2(g) △H=+285.8 kJ/mol
②H2(g)+ ![]() O2(g)=H2O(g) △H=-241.8 kJ/mol
O2(g)=H2O(g) △H=-241.8 kJ/mol
③NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ/mol
④C(s)+ ![]() O2(g)=CO(g) △H=-110.5 kJ/mol
O2(g)=CO(g) △H=-110.5 kJ/mol
⑤C(s)+O2(g)=CO2(g) △H=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于吸热反应的是____________________ 。
(2)C的燃烧热为____________________。
(3)燃烧10g H2生成液态水,放出的热量为______________。
(4)写出表示CO燃烧热的热化学方程式:__________________;写出制水煤气的热化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.将Na2S 溶液加入到含Hg2+的废水中,可生成HgS 沉淀
B.将 AlCl3 溶液加热、蒸干、灼烧,最终得到 Al2O3
C.工业合成氨选择高压而不是常压作为反应条件
D.用稀H2SO4 洗涤 BaSO4 沉淀,可减少沉淀损失量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中能达到相应实验目的的是
A | B | C | D | |
方案 |
|
|
润湿的pH试纸 |
将 NO2球分别浸泡在冷水和热水中 |
目 的 | 证明AgI 比AgCl更难溶 | 探究浓度对化学反应速率的影响 | 测定溶液的 pH | 探究温度对化学反应速率的影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水溶液中c(H+)与c(OH-)的变化关系如图中曲线a c所示,下列判断错误的是
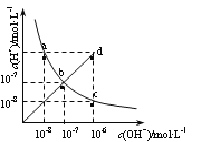
A.a c曲线上的任意一点都有c(H+)·c(OH-)=10-14
B.b d线段上任意一点对应的溶液都呈中性
C.d点对应溶液的温度高于25℃,pH<7
D.CH3COONa溶液不可能位于c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应4A+2B![]() 3C,下列说法中正确的是
3C,下列说法中正确的是
A. 某温度时,化学反应速率无论用A. B. C中任何物质表示,其数值都相同
B. 其他条件不变时,降低温度,化学反应速率减小
C. 其他条件不变时,增大压强,化学反应速率一定加快
D. 若增大或减小A的物质的量,化学反应速率一定会发生明显的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2经一系列反应可以得到硫酸和芒硝(Na2SO4·10H2O),其转化关系如图:

(1)SO2可用于H2SO4。已知25℃、101kPa 时:
2SO2(g)+O2(g)+2H2O(l) = 2H2SO4(l) ΔH1=-456kJ/mol
SO3(g)+H2O(l)=H2SO4(l) ΔH2=-130kJ/mol
则I中SO2(g)→SO3(g)的热化学方程式是_____。
(2)若Ⅲ中将SO2通入NaHCO3溶液中,反应的离子反应方程式是_____。已知:25℃时,H2CO3电离平衡常数:K1=4.3×10-7K2=5.6×10-11;H2SO3电离平衡常数:K1=1.5×10-2K2=6.0×10-8
(3)若Ⅲ中将SO2通入NaOH 溶液中,得到NaHSO3溶液,用化学用语表示NaHSO3在水溶液中存在的可逆过程_____。25℃时,SO2与NaOH溶液反应后的溶液中,含硫各微粒(H2SO3、![]() 和
和![]() )的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是_____(填字母)。
)的物质的量分数 X(i)与溶液 pH 的关系如图所示,下列说法不正确的是_____(填字母)。

A.为获得更多的NaHSO3,应将溶液的 pH 控制在 4~5
B.pH=3 时,溶液中 c(![]() )>c(H2SO3)> c(
)>c(H2SO3)> c(![]() )
)
C.由 M 点坐标,可以计算H2SO3H++![]() 的电离常数
的电离常数
D.pH=9 时,溶液中存在c(H+)=c(![]() )+2c(
)+2c(![]() )+c(OH-)
)+c(OH-)
(4)通过电解法可分离NaHSO3与Na2SO3混合物,如图所示,结合化学用语解释 c 室只排出Na2SO3的原因_____。

(5)步骤 IV 中可以将NaHSO3转化为Na2SO4的试剂是_____,_____(任意写两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700 ℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.20 | |
t2 | 0.80 |
依据题意回答下列问题:
(1)反应在t1 min内的平均速率为v(H2)=________ mol·L-1·min-1。
(2)保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,到达平衡时,n(CO2)=________mol。
(3)温度升至800 ℃,上述反应的平衡常数为0.64,则正反应为________反应(填“放热”或“吸热”)。
(4)700 ℃时,向容积为2 L的密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为1.20 mol、2.00 mol、1.20 mol、1.20 mol,则此时该反应v(正)________v(逆)(填“>”“<”或“=”)。
(5)该反应在t1时刻达到平衡,在t2时刻因改变某个条件,CO和CO2浓度发生变化的情况如图所示。图中t2时刻发生改变的条件可能是________或________。
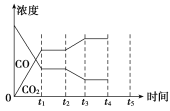
(6)若该容器容积不变,能说明反应达到平衡的是________。
①c(CO)与c(H2)的比值保持不变
②v(CO2)正=v(H2O)逆
③体系的压强不再发生变化
④混合气体的密度不变
⑤体系的温度不再发生变化
⑥气体的平均相对分子质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】降低大气中 CO2 的含量及有效地开发利用 CO2,已受到各国的普遍重视。目前工业上有一种方法是用 CO2 来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为 1L 的恒容密闭容器中,充入 1mol CO2 和 3mol H2,一定条件下发生反应: CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。测得CO2 和 CH3OH(g)的浓度随时间变化如下图所示。
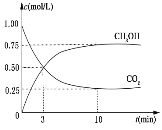
(1)在恒温恒容条件下,下列能说明反应达到化学平衡状态的是 _________(选填字母)
A.体系压强不再改变 B.气体密度不再改变 C.CO2 的浓度不再改变 D.v 正(CO2)= v 逆(H2)
(2) 从反应开始到平衡,氢气的平均反应速率 v(H2)=________mol/(L·min)。
(3)在该温度下,该反应的平衡常数为_________(保留小数点后 2 位)。
(4)下列措施中能使平衡体系中 n(CH3OH)/n(CO2)增大的是_________(选填字母)。
A.升高温度 B.充入 He(g),使体系压强增大 C.将 H2O(g)从体系中分离出去 D.再充入 1mol H2
(5)当反应达到平衡时,H2 的物质的量浓度为 c1,然后向容器中再加入一定量 H2,待反应再一次达到平衡后,H2 的物质的量浓度为 c2,则 c1________________c2(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com