
【题目】下列实验方案中能达到相应实验目的的是
A | B | C | D | |
方案 |
|
|
润湿的pH试纸 |
将 NO2球分别浸泡在冷水和热水中 |
目 的 | 证明AgI 比AgCl更难溶 | 探究浓度对化学反应速率的影响 | 测定溶液的 pH | 探究温度对化学反应速率的影响 |
A.AB.BC.CD.D
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】已知在高温、高压、催化剂作用下,1 mol 金刚石转化为石墨,放出 1.9 kJ 的热量。
(1)石墨和金刚石中,_____能量高,_____更稳定。
(2)推测石墨与金刚石各 1 mol 在相同条件下燃烧,_____放出的热量多。
(3)反应符合图示的是______________
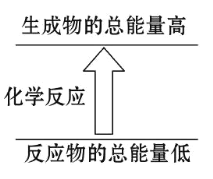
A.铝片与盐酸的反应
B.消石灰与 NH4Cl 晶体的反应
C.酸碱中和反应
D.甲烷在氧气中的燃烧反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素的最高价氧化物对应水化物的化学式分别为![]() 和
和![]() 。R、M同主族,R与冷水即可反应,M与热水反应缓慢。下列关系正确的是( )
。R、M同主族,R与冷水即可反应,M与热水反应缓慢。下列关系正确的是( )
A.原子半径:![]()
B.氢化物稳定性:![]()
C.原子核内质子数:![]()
D.最高价氧化物对应水化物的碱性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是
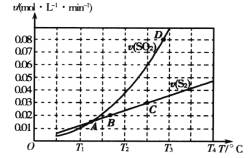
A. 该反应的H>0B. C点时达到平衡状态
C. 增加C的量能够增大SO2的转化率D. T3时增大压强,能增大活化分子百分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.请回答下列问题
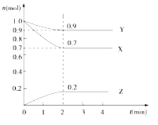
(1)由图中数据分析,该反应的化学方程式为___________________________
(2)反应开始至2min,Z的平均反应速率为________
(3)3min时,Z的生成速率与Z的消耗速率相比较,前者________(填“大于”“小于”或“等于”)后者.
(4)上述反应进行过程中,如果降低温度,则其反应速率________(填“增大”“减小”或“不变”).
(5)下列各项中不可以说明上述反应达到平衡的是________(填字母).
a.生成1molZ和同时生成1.5molX b. X、Y、Z的反应速率之比为3:2:1
c.同一物质的正反应速率等于逆反应速率 d.X的浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是
A.在溴水中存在如下平衡:Br2+H2O![]() HBr+HBrO,当加入NaOH溶液后颜色变浅
HBr+HBrO,当加入NaOH溶液后颜色变浅
B.对于反应:2HI(g)![]() H2(g)+I2(g),使平衡体系缩小体积增加压强,颜色变深
H2(g)+I2(g),使平衡体系缩小体积增加压强,颜色变深
C.Fe(SCN)3溶液中加入固体KSCN后颜色变深
D.棕红色气体NO2(2NO2![]() N2O4)缩小体积加压后,颜色先变深后变浅
N2O4)缩小体积加压后,颜色先变深后变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各溶液中微粒物质的量浓度关系不正确的是
A.pH=10 的Na2CO3 溶液:c(OH-)=c(![]() )+c(H+)+2c(H2CO3)
)+c(H+)+2c(H2CO3)
B.pH=13 的氨水与pH=1 的盐酸等体积混合:c(Cl-)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C.pH=7 的 Na2C2O4 和 NaHC2O4 混合溶液:c(Na+)=2c(![]() )+c(
)+c(![]() )
)
D.浓度均为 0.2 mol/L 的 NH4Cl 溶液与NaOH 溶液等体积混合:c(Na+)=c(Cl-)>c(OH-)>c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究溶液的 pH 对 KI 与 O2 反应的影响,实验如下。
装置 | 烧杯中的液体 | 现象 |
| ① 2 mL 1 mol/L KI 溶液+5 滴淀粉 | 5 分钟后无明显变化 |
② 2 mL 1 mol/L KI 溶液+5 滴淀粉+2 mL 0.2 mol/L HCl 溶液 | 5 分钟后溶液变蓝 | |
③ 2 mL 1 mol/L KI 溶液+5 滴淀粉+2 mL 0.2 mol/L KCl 溶液 | 5 分钟后无明显变化 | |
④ 2 mL pH=8.5 混有 KOH 的 1 mol/L KI 溶液+5 滴淀粉 | 5 小时后溶液才略变蓝 | |
⑤ 2 mL pH=10混有KOH的1 mol/L KI 溶液+5 滴淀粉 | 5 小时后无明显变化 |
(1)实验①中无现象,可能的原因是:i.KI与O2不反应,ii._____。
(2)若放置5小时后,实验①中的溶液变蓝,则反应的离子方程式是_____。
(3)去掉实验③,对该探究过程_____(填“有”或“没有”)影响。
(4)对比实验②和实验④,可以得出的结论是_____。
(5)对于实验⑤的现象,甲同学提出猜想“pH=10时O2不能氧化 I-”,设计了下列装置进行实验⑥,验证猜想。

i.烧杯a 中的溶液为_____。
ii. 实验结果是b 中溶液变蓝,此猜想不成立。通入O2后,a中的电极反应式是_____。
iii.实验⑥的结果说明实验⑤中“无明显现象的原因”是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,下列电解质溶液的有关叙述正确的是
A.在含有 BaSO4 沉淀的溶液中加入 Na2SO4 固体,c(Ba2+)增大
B.同物质的量浓度、同体积的强酸与强碱溶液混合后,溶液的 pH 一定等于 7
C.含 1mol KOH 的溶液与 1mol CO2 完全反应后,溶液中 c(K+)=c(![]() )
)
D.在 CH3COONa 溶液中加入适量 CH3COOH,可使 c(Na+)=c(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com