
����Ŀ��ij��ȤС��̽����Һ�� pH �� KI �� O2 ��Ӧ��Ӱ�죬ʵ�����¡�
װ�� | �ձ��е�Һ�� | ���� |
| �� 2 mL 1 mol/L KI ��Һ��5 �ε��� | 5 ���Ӻ������Ա仯 |
�� 2 mL 1 mol/L KI ��Һ��5 �ε��ۣ�2 mL 0.2 mol/L HCl ��Һ | 5 ���Ӻ���Һ���� | |
�� 2 mL 1 mol/L KI ��Һ��5 �ε��ۣ�2 mL 0.2 mol/L KCl ��Һ | 5 ���Ӻ������Ա仯 | |
�� 2 mL pH��8.5 ���� KOH �� 1 mol/L KI ��Һ��5 �ε��� | 5 Сʱ����Һ���Ա��� | |
�� 2 mL pH��10����KOH��1 mol/L KI ��Һ��5 �ε��� | 5 Сʱ�������Ա仯 |
(1)ʵ�������������ܵ�ԭ���ǣ�i.KI��O2����Ӧ��ii._____��
(2)������5Сʱ��ʵ�����е���Һ��������Ӧ�����ӷ���ʽ��_____��
(3)ȥ��ʵ�������Ը�̽������_____(������������û����)Ӱ�졣
(4)�Ա�ʵ������ʵ���������Եó��Ľ�����_____��
(5)����ʵ����������ͬѧ���������pH=10ʱO2�������� I-�������������װ�ý���ʵ��������֤���롣

i.�ձ�a �е���ҺΪ_____��
ii. ʵ������b ����Һ�������˲��벻������ͨ��O2��a�еĵ缫��Ӧʽ��_____��
iii.ʵ�����Ľ��˵��ʵ�������������������ԭ������_____��
���𰸡�KI �� O2 ��Ӧ������ 4I��+O2+2H2O=I2+4OH�� �� KI �� O2 ��Ӧ�����������·�Ӧ���ʱȼ��������¿� pH=10 �� KOH ��Һ O2+2H2O+4e��= 4OH�� ���ɵ�I2 �� OH����Ӧ
��������
(1) ʵ������5 ���Ӻ������Ա仯�����Ƿ�Ӧ��û�з�����Ҳ�����Ƿ�Ӧ����̫����ʱ��̫�̲����Թ۲쵽����
�ʴ�Ϊ��KI ��O2��Ӧ��������
(2)������5Сʱ��ʵ�����е���Һ����������Ϊ�������ܱ�����������I2����Ӧ���ӷ���ʽΪ��4I��+O2+2H2O=I2+4OH����
�ʴ�Ϊ��4I��+O2+2H2O=I2+4OH����
(3) �Ա�ʵ������ʵ���������ų������ӶԷ�Ӧ��Ӱ�죬���ȥ��ʵ��������˵�������ӶԷ�Ӧ�Ƿ���Ӱ�죬
�ʴ�Ϊ���У�
(4) �Ա�ʵ������ʵ������һ�����������·�Ӧ��һ���Ǽ��������·�Ӧ�������ж���Һ����ԶԷ�Ӧ���ʵ�Ӱ�죬�������֪KI ��O2��Ӧ�����������·�Ӧ���ʱȼ��������¿죻
�ʴ�Ϊ��KI ��O2��Ӧ�����������·�Ӧ���ʱȼ��������¿�
(5)i�����ͬѧ���������pH=10ʱO2��������I-��������ͨ������һ���ձ���Ӧ��pH=10 �� KOH ��Һ��
�ʴ�Ϊ: pH=10 �� KOH ��Һ;
ii. ʵ������b ����Һ������˵��pH=10ʱ�������������������ӣ��Ӷ�˵�����벻������ͨ��O2��a�еĵ缫��Ӧʽ��O2+2H2O+4e��= 4OH����
�ʴ�Ϊ��O2+2H2O+4e��= 4OH����
iii.ʵ�����Ľ��˵��pH=10ʱ�������������������ӣ���ʵ�������������������ԭ����ֻ���Dz����ĵⵥ�ʱ������ĵ��£������ɵ�I2�� OH����Ӧ��
�ʴ�Ϊ�����ɵ�I2�� OH����Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L�����ܱ������У�ij���淴Ӧ(ABC��Ϊ����)���й����У� �ڲ�ͬ��Ӧʱ����������ʵ����ı仯�����ͼ��ʾ����÷�Ӧ�Ļ�ѧ����ʽΪ_________________����ʼ��2����ʱ����C��ʾ�䷴Ӧ����Ϊ__________��
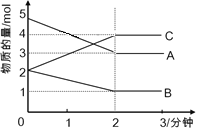
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽�����ܴﵽ��Ӧʵ��Ŀ�ĵ���
A | B | C | D | |
���� |
|
|
��ʪ��pH��ֽ |
�� NO2��ֱ��������ˮ����ˮ�� |
Ŀ �� | ֤��AgI ��AgCl������ | ̽��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�� | �ⶨ��Һ�� pH | ̽���¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ4A��2B![]() 3C������˵������ȷ����
3C������˵������ȷ����
A. ij�¶�ʱ����ѧ��Ӧ����������A�� B�� C���κ����ʱ�ʾ������ֵ����ͬ
B. ������������ʱ�������¶ȣ���ѧ��Ӧ���ʼ�С
C. ������������ʱ������ѹǿ����ѧ��Ӧ����һ���ӿ�
D. ��������СA�����ʵ�������ѧ��Ӧ����һ���ᷢ�����Եı仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2��һϵ�з�Ӧ���Եõ������â��(Na2SO4��10H2O)����ת����ϵ��ͼ��

(1)SO2������H2SO4����֪25�桢101kPa ʱ��
2SO2(g)��O2(g)��2H2O(l) = 2H2SO4(l) ��H1����456kJ/mol
SO3(g)��H2O(l)=H2SO4(l) ��H2����130kJ/mol
��I��SO2(g)��SO3(g)���Ȼ�ѧ����ʽ��_____��
(2)�����н�SO2ͨ��NaHCO3��Һ�У���Ӧ�����ӷ�Ӧ����ʽ��_____����֪��25��ʱ��H2CO3����ƽ�ⳣ����K1��4.3��10-7K2��5.6��10-11��H2SO3����ƽ�ⳣ����K1��1.5��10-2K2��6.0��10-8
(3)�����н�SO2ͨ��NaOH ��Һ�У��õ�NaHSO3��Һ���û�ѧ�����ʾNaHSO3��ˮ��Һ�д��ڵĿ������_____��25��ʱ��SO2��NaOH��Һ��Ӧ�����Һ�У��������(H2SO3��![]() ��
��![]() )�����ʵ������� X(i)����Һ pH �Ĺ�ϵ��ͼ��ʾ������˵������ȷ����_____(����ĸ)��
)�����ʵ������� X(i)����Һ pH �Ĺ�ϵ��ͼ��ʾ������˵������ȷ����_____(����ĸ)��

A.Ϊ��ø����NaHSO3��Ӧ����Һ�� pH ������ 4��5
B.pH��3 ʱ����Һ�� c(![]() )��c(H2SO3)�� c(
)��c(H2SO3)�� c(![]() )
)
C.�� M �����꣬���Լ���H2SO3H+��![]() �ĵ��볣��
�ĵ��볣��
D.pH��9 ʱ����Һ�д���c(H+)��c(![]() )��2c(
)��2c(![]() )��c(OH-)
)��c(OH-)
(4)ͨ����ⷨ�ɷ���NaHSO3��Na2SO3������ͼ��ʾ����ϻ�ѧ������� c ��ֻ�ų�Na2SO3��ԭ��_____��

(5)���� IV �п��Խ�NaHSO3ת��ΪNa2SO4���Լ���_____��_____(����д����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����⻯��(NaAlH4) ���л��ϳɵ���Ҫ��ԭ������������(��Ҫ�ɷ�ΪAl2O3����SiO2��Fe2O3������) Ϊԭ���Ʊ����⻯�Ƶ�һ�ֹ�����������:

ע: SiO2����������ʱת��Ϊ��������(Na2Al2SixO8) ������
��1����������(Na2Al2SixO8) ���������������ʽ��ʾ����ɣ���ʽΪ________��
��2�� ������I����������Ҫ�ɷ���________(д����)����������I��������Һ�м���NaHCO3��Һ����Ӧ�����ӷ���ʽΪ_______________��______________��
��3�������I������һ������1000��ʱ����N2��Ӧ�Ʊ�AlN�������ֲ�������������NH4Cl���岢��ֻ�ϣ�������AlN ���Ʊ�������Ҫԭ����__________________��
��4�������II���ǵ��Na2CO3��Һ��ԭ����ͼ��ʾ��

�����ĵ缫��ӦʽΪ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��700 ��ʱ�����ݻ�Ϊ2 L���ܱ������г���һ������CO��H2O��������Ӧ��CO(g)��H2O(g) CO2(g)��H2(g)����Ӧ�����вⶨ�IJ������ݼ��±�(����t2>t1)��
��Ӧʱ��/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.20 | |
t2 | 0.80 |
��������ش��������⣺
(1)��Ӧ��t1 min�ڵ�ƽ������Ϊv(H2)��________ mol��L��1��min��1��
(2)���������������䣬��ʼʱ�������г���0.60 mol CO��1.20 mol H2O������ƽ��ʱ��n(CO2)��________mol��
(3)�¶�����800 �棬������Ӧ��ƽ�ⳣ��Ϊ0.64��������ӦΪ________��Ӧ(��������������������)��
(4)700 ��ʱ�����ݻ�Ϊ2 L���ܱ������г���CO(g)��H2O(g)��CO2(g)��H2(g)�����ʵ����ֱ�Ϊ1.20 mol��2.00 mol��1.20 mol��1.20 mol�����ʱ�÷�Ӧv(��)________v(��)(����>����<����������)��
(5)�÷�Ӧ��t1ʱ�̴ﵽƽ�⣬��t2ʱ����ı�ij��������CO��CO2Ũ�ȷ����仯�������ͼ��ʾ��ͼ��t2ʱ�̷����ı������������________��________��
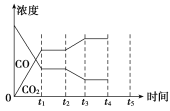
(6)���������ݻ����䣬��˵����Ӧ�ﵽƽ�����________��
��c(CO)��c(H2)�ı�ֵ���ֲ���
��v(CO2)����v(H2O)��
����ϵ��ѹǿ���ٷ����仯
�ܻ��������ܶȲ���
����ϵ���¶Ȳ��ٷ����仯
�������ƽ����Է�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���绯ѧ�ֶζ����о����������Լ���ҵ�����ж�����Ҫ��ֵ��
I. ijʵ��С������ԭ���װ�ö� FeCl3��Na2SO3�ķ�Ӧ����̽����
װ�� | ʵ������ |
1 mol/L FeCl3��Һ(pH��1) 1mol/LNa2SO3 ��Һ(pH��9) | ����������ָ�뷢��ƫת |
(1)ȡ���� FeCl3��Һ�缫�����Ļ��Һ���������軯����Һ��������ɫ������֤�� FeCl3ת����_____��
(2)������һ�缫����IJ�����������_____��
(3)�����ĵ缫��ӦʽΪ_____��
II. ��ҵ���� Na2SO4 ��Һ���չ�ҵ�����еĵ�Ũ�� SO2 �γ�����Һ���ٲ���������Ĥ��ⷨ�� ���Ƶ�ѹ���������Һ���Ƴɲ�Ʒ S �� O2������ԭ��ʾ��ͼ����ͼ

����������������pH ��ʱ��ı仯��ϵ����ͼ��

(4)������Ӧ�ĵ缫��Ӧ���� ____��
(5)������ pH ���͵�ԭ����____��(д��һ������)
(6) ��ϵ缫��Ӧʽ��˵�������� pH ���ߵ�ԭ��_____��(д��һ������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���п�Ժ������ѧ�����о��������һ������Na-Fe3O4/HZSM-5��ܸ��ϴ������ɹ�ʵ����CO2ֱ�Ӽ�����ȡ������ֵ���ͣ����о��ɹ�������Ϊ��CO2��ת�������ͻ���Խ�չ����
(1)��֪��2H2(g)+O2(g)=2H2O(l) ��H=��571.6kJ��mol-1
C8H18(l)+![]() O2(g)=8CO2(g)+9H2O(l) ��H=��5518kJ��mol-1
O2(g)=8CO2(g)+9H2O(l) ��H=��5518kJ��mol-1
��8CO2(g)+25H2(g)=C8H18(l)+16H2O(l) ��H=___kJ��mol-1��
(2)������(NH3BH3)�Ǵ�������ߵIJ���֮һ�������黹����ȼ�ϵ�أ��乤��ԭ����ͼ1��ʾ���������ع���ʱ�����ĵ缫��ӦʽΪ__________��

(3)��������Ļ�������NaBH4��NaBO2����֪NaBH4����ˮ����NaBO2��H2��д���仯ѧ����ʽ_______��![]() ΪNaBH4��Ӧ�İ�˥�ڣ���Ӧһ������Ҫ��ʱ�䣬��λΪmin����lgt1/2��pH���¶ȵı仯��ͼ2��ʾ����T1______T2������>������<������
ΪNaBH4��Ӧ�İ�˥�ڣ���Ӧһ������Ҫ��ʱ�䣬��λΪmin����lgt1/2��pH���¶ȵı仯��ͼ2��ʾ����T1______T2������>������<������
(4)ȼ������β�����д�����NO���ڻ���V2O5�������£�������NO��ԭ��N2��һ�ַ�Ӧ������ͼ3��ʾ��

����ͼд���ܷ�Ӧ�Ļ�ѧ����ʽ_______________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com