
【题目】下列事实不能用勒夏特列原理解释的是
A.将Na2S 溶液加入到含Hg2+的废水中,可生成HgS 沉淀
B.将 AlCl3 溶液加热、蒸干、灼烧,最终得到 Al2O3
C.工业合成氨选择高压而不是常压作为反应条件
D.用稀H2SO4 洗涤 BaSO4 沉淀,可减少沉淀损失量
【答案】A
【解析】
A.将Na2S溶液加入到含Hg2+的废水中,发生S2-+Hg2+=HgS![]() 反应,可生成HgS 沉淀,不能用勒夏特列原理解释,故A符合题意;
反应,可生成HgS 沉淀,不能用勒夏特列原理解释,故A符合题意;
B.在AlCl3溶液中存在:Al3++3H2O![]() Al(OH)3+3H+水解平衡,加热促进水解,平衡正向移动,产生Al(OH)3沉淀,符合勒夏特列原理,蒸干、灼烧Al(OH)3,发生2Al(OH)3
Al(OH)3+3H+水解平衡,加热促进水解,平衡正向移动,产生Al(OH)3沉淀,符合勒夏特列原理,蒸干、灼烧Al(OH)3,发生2Al(OH)3![]() Al2O3+3H2O反应,最终得到Al2O3,故B不符合题意;
Al2O3+3H2O反应,最终得到Al2O3,故B不符合题意;
C.工业合成氨的反应为:N2+3H2![]() 2NH3,增大压强,平衡正向移动,促进氨气的生成,符合勒夏特列原理,故C不符合题意;
2NH3,增大压强,平衡正向移动,促进氨气的生成,符合勒夏特列原理,故C不符合题意;
D. BaSO4在溶液中存在:BaSO4(s)![]() Ba2-(aq)+SO42-(aq),用稀H2SO4洗涤沉淀,增大SO42-离子的浓度,平衡逆向移动可减少沉淀损失量,符合勒夏特列原理,故D不符合题意;
Ba2-(aq)+SO42-(aq),用稀H2SO4洗涤沉淀,增大SO42-离子的浓度,平衡逆向移动可减少沉淀损失量,符合勒夏特列原理,故D不符合题意;
故答案为A。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】下列各项中的两个量,其比值一定为![]() 的是
的是![]()
![]()
A.液面在“0”刻度时,![]() 碱式滴定管和
碱式滴定管和![]() 碱式滴定管所盛液体的体积
碱式滴定管所盛液体的体积
B.相同温度下,![]() 醋酸溶液和
醋酸溶液和![]() 醋酸溶液中的
醋酸溶液中的![]()
C.在![]() 溶液中,
溶液中,![]() 与
与![]()
D.相同温度下,等浓度的![]() 和NaOH溶液,前者与后者的
和NaOH溶液,前者与后者的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】央视报道《王者归“铼”》:中国发现超级金属“铼”,飞机火箭上天全靠它,有望打破美国垄断。
(1)铼(Re)被称为类锰元素,与锰的外围电子结构数相同,已知Mn的外围电子排布式为3d54s2,写出75Re的外围电子排布式:______,其最高价氧化物的化学式为_______。
(2)铢合金可作为醇脱氢反应的催化剂:CH3OH![]() HCHO+H2↑,上述反应两种有机物中碳原子的杂化形式分别是______和_______。C、H、O三种元素中,电负性最大的是______(填元素符号)。
HCHO+H2↑,上述反应两种有机物中碳原子的杂化形式分别是______和_______。C、H、O三种元素中,电负性最大的是______(填元素符号)。
(3)实验中常用过硫酸盐氧化法测定钢铁中锰的含量,反应原理为2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+。已知H2S2O8的结构简式如图所示。
2MnO4-+10SO42-+16H+。已知H2S2O8的结构简式如图所示。
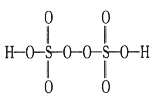
上述反应中S2O82-断裂的共价键类型为___(填“σ键”或“π键”),每生成0.3molMnO4-,过硫酸根中断裂的共价键数目为_____NA。
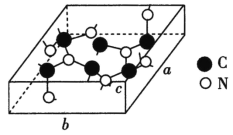
(4)科学家研制出一种新型的超硬材料,类似于金刚石的结构,但硬度比金刚石大,该晶体元素组成为C和N,其晶胞如图所示(图示原子都包含在晶胞内),则该晶胞所含氮原子的个数为____。已知晶胞参数分别为a nm、b nm、c nm,,该晶体的摩尔质量为Mg·mol-1,密度为ρg·cm-3,则阿伏加德罗常数的数值为___(用含a、b、c、ρ、M的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素的最高价氧化物对应水化物的化学式分别为![]() 和
和![]() 。R、M同主族,R与冷水即可反应,M与热水反应缓慢。下列关系正确的是( )
。R、M同主族,R与冷水即可反应,M与热水反应缓慢。下列关系正确的是( )
A.原子半径:![]()
B.氢化物稳定性:![]()
C.原子核内质子数:![]()
D.最高价氧化物对应水化物的碱性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水硫酸铜(CuSO4)为白色或灰白色粉末。其水溶液显蓝色,呈弱酸性。可用作杀菌剂和电解精炼铜时的电解液。某化学课外活动小组通过设计硫酸铜受热分解的探究实验,测定气体产物的成分(已知硫酸铜完全分解,固体产物仅含CuO)。实验装置如图所示,回答下列问题

(1)实验前需进行的操作是_________,仪器a的名称是_____,加热时试管外壁必须干燥,要先均匀加热,再集中加热,其目的是__________。
(2)实验结束时根据f中量筒是否收集到水,确定气体产物中有无_______(填化学式)。
(3)装置c的作用是_________。
(4)装置d中的化学方程式为____,_____。有小组成员建议在装置d后增加连接一个干燥管,其原因是_______。
(5)按完善装置的实验结束前后测得相关数据如下:(填化学式)。
实验前无水硫酸铜的质量/g | 实验后装置d增加的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
6.4 | 2.56 | 224 |
通过计算,写出CuSO4受强热分解的化学方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) ![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示,下列说法正确的是
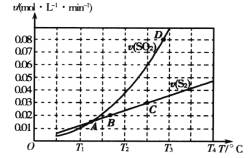
A. 该反应的H>0B. C点时达到平衡状态
C. 增加C的量能够增大SO2的转化率D. T3时增大压强,能增大活化分子百分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.请回答下列问题
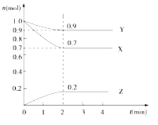
(1)由图中数据分析,该反应的化学方程式为___________________________
(2)反应开始至2min,Z的平均反应速率为________
(3)3min时,Z的生成速率与Z的消耗速率相比较,前者________(填“大于”“小于”或“等于”)后者.
(4)上述反应进行过程中,如果降低温度,则其反应速率________(填“增大”“减小”或“不变”).
(5)下列各项中不可以说明上述反应达到平衡的是________(填字母).
a.生成1molZ和同时生成1.5molX b. X、Y、Z的反应速率之比为3:2:1
c.同一物质的正反应速率等于逆反应速率 d.X的浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各溶液中微粒物质的量浓度关系不正确的是
A.pH=10 的Na2CO3 溶液:c(OH-)=c(![]() )+c(H+)+2c(H2CO3)
)+c(H+)+2c(H2CO3)
B.pH=13 的氨水与pH=1 的盐酸等体积混合:c(Cl-)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
C.pH=7 的 Na2C2O4 和 NaHC2O4 混合溶液:c(Na+)=2c(![]() )+c(
)+c(![]() )
)
D.浓度均为 0.2 mol/L 的 NH4Cl 溶液与NaOH 溶液等体积混合:c(Na+)=c(Cl-)>c(OH-)>c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 一定量的甲烷恰好与一定量的氧气完全反应后得到CO、CO2和水蒸气共30.4g,该产物缓缓通过浓硫酸充分吸收后,浓硫酸增重14.4g,则此甲烷完全燃烧还需要氧气的体积(标准状况)为
A.1.12L B.2.24L C.3.36L D.4.48L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com