
【题目】常温时,浓度均为1mol·L-1的CH3NH2和NH2OH两种碱溶液,起始时的体积都为10mL。分别向两溶液中加水进行稀释,所得曲线如图所示(V表示溶液的体积),pOH=-lg[c(OH-)]。下列说法正确的是( )
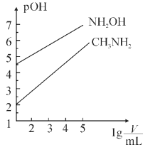
A.当两溶液均稀释至lg![]() =5时,溶液中水的电离程度:NH2OH<CH3NH2
=5时,溶液中水的电离程度:NH2OH<CH3NH2
B.常温下,用盐酸滴定NH2OH时,可用酚酞作指示剂
C.CH3NH3Cl溶液中存在关系:2c(H+)+c(CH3NH)=c(CH3NH2)+2c(OH-)+c(Cl-)
D.等浓度的CH3NH3Cl和NH3OHCl的混合溶液中离子浓度大小关系为:c(NH3OH+)>c(CH3NH+)
【答案】C
【解析】
根据图示,二者稀释相同的倍数,NH2OH的pOH值大于CH3NH2溶液,pOH越小,碱性越强,则NH2OH的碱性弱于CH3NH2,据此分析解答。
A.当两溶液均稀释至lg![]() =5时,NH2OH的pOH值大于CH3NH2溶液,pOH越小,碱性越强,对水的电离抑制作用越大,则溶液中中水的电离程度:NH2OH>CH3NH2,故A错误;
=5时,NH2OH的pOH值大于CH3NH2溶液,pOH越小,碱性越强,对水的电离抑制作用越大,则溶液中中水的电离程度:NH2OH>CH3NH2,故A错误;
B.常温下,用盐酸滴定NH2OH达到终点时生成的NH3OHCl为酸性,应用甲基橙作指示剂,故B错误;
C.CH3NH3Cl溶液中存在电荷守恒:c(H+)+c(CH3NH3+)=c(OH-)+c(Cl-),质子守恒式为:c(H+)=c(CH3NH2)+c(OH-),两式相加可得:2c(H+)+c(CH3NH3+)=c(CH3NH2)+2c(OH-)+c(Cl-),故C正确;
D.1molL1的CH3NH2比1molL1的NH2OH的pOH值小,即碱性强,根据水解规律,越弱越水解,NH3OH+的水解程度大,所以浓度相同的CH3NH3Cl和NH3OHCl的混合溶液中离子浓度大小关系:c(NH3OH+)<c(CH3NH3+),故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如表所示。请回答下列问题:
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) | ΔH3 | K3 | |||
(1)反应②是____(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=____(用K1、K2表示);根据反应③判断ΔS___0(填“>”、“=”或“<”),在____(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol/L、0.8mol/L、0.3mol/L、0.15mol/L,则此时v(正)___v(逆)(填“>”、“=”或“<”)。
(4)根据上述表格测得焓变,下列能量关系图合理的是_____
A. B.
B.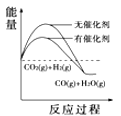 C.
C.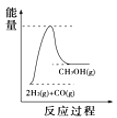 D.
D.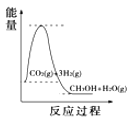
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或装置正确且能达到目的的是( )
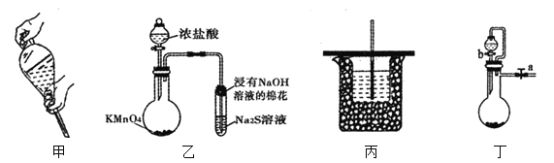
A.图甲操作将溶液转移至分液漏斗中,加入萃取剂后,塞上玻璃塞用力振摇
B.用装置乙可进行比较KMnO4、Cl2、S的氧化性强弱
C.用装置丙可进行中和热的测定
D.用装置丁,关闭a,打开b,可检验装置的气密性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲配制480 mL 0.5 mol·L-1的NaOH溶液,请按要求完成下列内容:
(1)完成本实验时,下列仪器中一定不需要的是________(填字母,下同)。

(2)通过计算可知,需天平称量NaOH固体的质量为______g。
(3)配制过程一般可分为以下几个步骤:①称量、②计算、③溶解、④摇匀、⑤转移、⑥洗涤、⑦定
容、⑧振荡、⑨装瓶贴签,正确的操作顺序为_____(填序号)。小明认为还缺少一个步骤,此步骤的名称是______。
(4)实验结束后,发现所配溶液浓度偏大,可能的原因是________(填代号)。
A. 所用NaOH已潮解 B. 定容时俯视观察液面
C. 未洗涤烧杯 D. 称量时砝码与NaOH的位置颠倒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下有:① 6.72 L CH4,② 3.01×1023个HCl分子,③ 13.6 g H2S,④ 0.2 mol NH3。下列对这四种气体的描述正确的是( )
A.体积②>③>①>④B.密度 ②<③<④<①
C.质量②>③>④>①D.氢原子个数 ①<③<④<②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是地球上组成生命的最基本元素之一,与其他元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。碳及其化合物在研究和生产中有许多重要用途。回答下列问题:
(1)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。
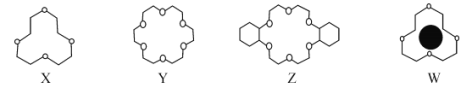
①Li+与X的空腔大小相近,恰好能进入到X的环内,且与氧原子的一对孤电子对作用形成稳定结构W(如图)。基态碳原子核外有___种运动状态不同的电子,其外围电子轨道表示式为___。W中Li+与孤对电子之间的作用属于___(填标号)。
A.离子键 B.共价键 C.氢键 D.配位键 E.以上都不是
②冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构,理由是___。
③冠醚分子中氧的杂化轨道的空间构型是___,C—O—C的键角___(填“>”“<”或“=”)109°28′。
(2)碳的一种同素异形体——石墨,其晶体结构及晶胞如图1、图2所示。则石墨晶胞含碳原子个数为___个。已知石墨的密度为ρg·cm-3,C—C键键长为rcm,阿伏加德罗常数的值为NA,计算石墨晶体的层间距d为___cm。
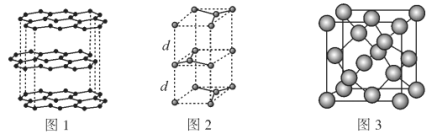
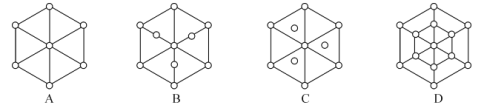
(3)碳的另一种同素异形体——金刚石,其晶胞如图3所示。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是图___ (从A~D图中选填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出反应的热化学方程式或计算反应热.
(1)在25℃、101kPa下,1g液态甲醇燃烧生成CO2和液态水时放出22.5kJ热量.则该反应的热化学方程式为_____.
(2)已知下列反应的反应热为:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=﹣880kJ/mol.
②C(s)+O2(g)═CO2(g)△H2=﹣393 kJ/mol.
③H2(g)+![]() O2(g)═H2O(l)△H3=﹣285.8kJ/mol
O2(g)═H2O(l)△H3=﹣285.8kJ/mol
则反应:C(s)+2H2(g)+CO2(g)=CH3COOH(l)△H=_____kJmol﹣1.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B. 图Ⅱ表示常温下,0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000mol·L-1 CH3COOH溶液所得到的滴定曲线
C. 图Ⅲ表示一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化曲线,图中a、b、c三点醋酸的电离程度:a<b<c
D. 图Ⅳ表示反应4CO(g)+2NO2(g ) ![]() N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
N2(g)+4CO2(g) ΔH <0,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定某NaOHmolL-1溶液的物质的量浓度,可用0.100的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为______________;
(2)盛装标准盐酸的仪器名称为______________;
(3)滴定至终点的颜色变化为______________;
(4)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为______________;

(5)乙学生做了三组平行实验,数据记录如下:
选取下述合理数据,计算出待测NaOH溶液的物质的量浓度为______________; (保留四位有效数字)
实验序号 | 待测NaOH溶液的体积/mL | 0.1000molL-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.00 | 31.00 |
3 | 25.00 | 1.00 | 27.31 |
(6)下列哪些操作会使测定结果偏高_________(填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com