
| A、化合反应都不是氧化还原反应 |
| B、有单质生成的分解反应一定是氧化还原反应 |
| C、有一些置换反应不是氧化还原反应 |
| D、有氧元素参与的复分解反应是氧化还原反应 |


科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
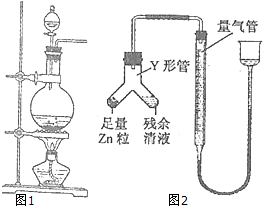 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1示).查看答案和解析>>
科目:高中化学 来源: 题型:

| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化氢:Mg2+、K+、NO3-、SiO32- |
| B、氨气:Ag+,NH4+、Na+、NO3- |
| C、氯气:Na+、Al3+、Br-、SO32- |
| D、二氧化碳:K+、Ca2+、NH3?H2O、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用H2O2酸性溶液,将海带灰中的I-转变为I2:H2O2+2I-═I2+2OH- |
| B、高锰酸钾与足量浓盐酸反应制氯气:2MnO4-+16H++10Cl-═2Mn2++5Cl2↑+8H2O |
| C、AlCl3溶液中滴加过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| D、漂白粉溶液中,通入过量的二氧化碳:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知醋酸是日常生活中常见的弱酸.
已知醋酸是日常生活中常见的弱酸.查看答案和解析>>
科目:高中化学 来源: 题型:
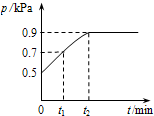 在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )A、从反应开始到t1时的平均反应速率v(X)=
| ||
| B、该温度下此反应的平衡常数K=0.32 | ||
| C、欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | ||
| D、其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com