
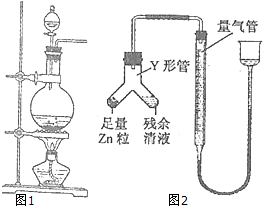
 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1示).
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1示).
| ||
| ||


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、澄清石灰水与盐酸混合:OH-+H+=H2O |
| C、NaOH溶液与CuSO4溶液反应2OH-+Cu2+=Cu(OH)2↓ |
| D、铜与 AgNO3溶液反应 Cu+2Ag+=2Ag+Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 一定条件 |
| 一定条件 |

| 一定条件 |
| ① |
| 一定条件 |
| ② |

查看答案和解析>>
科目:高中化学 来源: 题型:
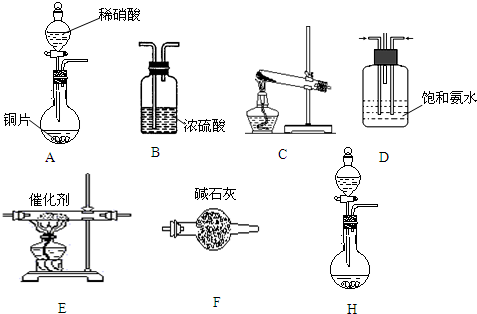
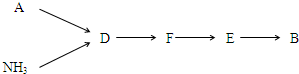
查看答案和解析>>
科目:高中化学 来源: 题型:
| 探究内容 | 实验方案 | 实验现象 |
| 探究 Fe 2+ 具有还原性 | ||
| 探究 Fe 2+ 具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化合反应都不是氧化还原反应 |
| B、有单质生成的分解反应一定是氧化还原反应 |
| C、有一些置换反应不是氧化还原反应 |
| D、有氧元素参与的复分解反应是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该气体一定是纯净物 |
| B、该气体一定是CO、CO2的混合物 |
| C、该气体中所含的物质最多只有2种 |
| D、该气体的组成情况可能有3种组合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com