
����Ŀ��һ�ִ��Բ��ϵ�ĥ�����ϣ�������������Լ21%����Ҫ�ɷ��������Ͻ𣬻�����ͭ���ơ�þ�����������ɸ÷����Ʊ����Ƚϸߵ�����������������������

�ش��������⣺
��1����������ʱ����Һ����Fe3����Fe2����Ni2�������ɣ���������Ҫ�ɷ���__________���������ܽ�����ӷ���ʽΪ__________________________________________��
��2����������ʱH2O2��������___________________������̼���Ƶ�Ŀ����__________________________________________��
��3������ͭ��ʱ����Ӧ�����ӷ���ʽΪ_____________________________________������Na2S����H2S��ͭ���ŵ���__________��
��4����֪����þ�������մ������н��У�NaF��ʵ���������ܹ��������Ϊ_____________________��
��5����֪������Ksp[Ni(OH)2]=2.0��10��15�������������������������������ҺpHԼΪ_______��Ni2���Ÿպó�����ȫ�����ӳ�����ȫ��Ũ����10��5 mol/L��lg2=0.30��
���𰸡�SiO2 5Ni+12H++2NO3-=5Ni2++N2��+6H2O ��������������Ϊ������ ������Һ��pH��ʹFe3+��ȫ����Ϊ���������� H2S+Cu2+=CuS��+2H+ ���ӷ����ж�����H2S�ݳ����ɱ������� ������F-���������ḯʴ�մ����� 9.15
��������
������ϡ���ᡢϡ�������ܷ�Ӧ����������������������˫��ˮ����ǿ�����ԣ�����˫��ˮĿ���ǽ�Fe2+ȫ������ΪFe3+������̼���Ƶ���pH�����������ӣ�ͨ���������ͭ���ӣ��������ͭ���ӷ�Ӧ������ͭ����������ƣ������ɷ����ơ�����þ������������pH������������������
(1) SiO2��������������ᣬ�ʡ����ܡ�ʱ����������Ҫ�ɷ���SiO2���������ܽ�ʱ������Ϊ�����ӵ�ͬʱ���ᱻ��ԭ������������Ӧ�����ӷ���ʽΪ5Ni+12H++2NO3-=5Ni2++N2��+6H2O����2��˫��ˮ����ǿ�����ԣ�����˫��ˮĿ���ǽ�Fe2+ȫ������ΪFe3+������̼���Ƶ�Ŀ���ǵ�����Һ��pH��ʹFe3+��ȫ����Ϊ��������������3��������ͭ���ӷ�Ӧ������ͭ������H2S+Cu2+=CuS��+2H+��Na2S��ͭ���ӷ�Ӧ����CuS����������Na2S����H2S��ͭ�������ӷ����ж�����H2S�ݳ����ɱ�����������ͭЧ�����ã�(4)������ˮ�����ɷ����⣬��ʴ�մ���������NaF��ʵ���������ܹ��ࣻ(5) Ksp[Ni(OH)2]=c(Ni2+)c2(OH-)=1.0��10-5mol/L��c2(OH-)= 2.0��10-15����c(OH-)= ![]() ��10-5��c(H+)=
��10-5��c(H+)=![]() ���������ڡ������������У��������ҺpHԼΪ9.15ʱ��Ni2+�Ÿպó�����ȫ��
���������ڡ������������У��������ҺpHԼΪ9.15ʱ��Ni2+�Ÿպó�����ȫ��


 Сѧ�̲�ȫ��ϵ�д�
Сѧ�̲�ȫ��ϵ�д� Сѧ��ѧ������ѿڶ���ϵ�д�
Сѧ��ѧ������ѿڶ���ϵ�д� ������Ӧ�������������ϵ�д�
������Ӧ�������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������зḻ����Դ����ͼΪ��ˮ���õIJ��ֹ��̡������й�˵����ȷ����

A. �ɷ�Ӧ�ٿ�֪����ͬ�¶��£�NaHCO3���ܽ�ȴ���Na2CO3
B. ͨ�����MgCl2��6H2O������Ի��Mg����
C. ��Ӧ�ڵ����ӷ���ʽΪ��Br2��SO2��2H2O��SO42����2Br����4H+
D. �����к��е�Mg2����SO42�����������ӣ���ͨ�����μ���BaCl2��Һ��NaOH��Һ��������Լ�����ȥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����
A. ����![]() ��Һ�м���˫��ˮ��
��Һ�м���˫��ˮ��![]()
B. ��![]() ��Һ�е���
��Һ�е���![]() ��Һ��
��Һ��![]() ǡ����ȫ������
ǡ����ȫ������![]()
C. ̼��ƺ����ᷴӦ��![]()
D. �����м���![]() ��Һ��
��Һ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧͨ������װ�òⶨM��Ʒ��ֻ��![]() ��
��![]() ��
��![]() ���и��ɷֵ�����������ȡ����������Ϊ
���и��ɷֵ�����������ȡ����������Ϊ![]() ��M��Ʒ����ʵ��1����ͼ1����ʵ��2����ͼ2������ʵ�飬��ͬѧ˳�������ʵ�鲢�����������ֱ�Ϊ
��M��Ʒ����ʵ��1����ͼ1����ʵ��2����ͼ2������ʵ�飬��ͬѧ˳�������ʵ�鲢�����������ֱ�Ϊ![]() ��
��![]() �������㵽��״���£���
�������㵽��״���£���
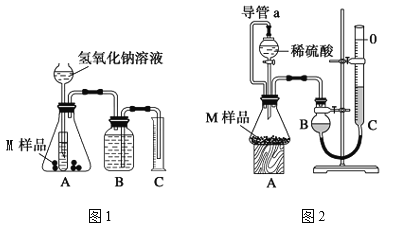
��1����ʵ��������ϡ��������98����Ũ����![]() ���Ƶģ����Ũ��������ʵ���Ũ����______
���Ƶģ����Ũ��������ʵ���Ũ����______![]() ��
��
��2��д��ʵ��1�п��ܷ�����Ӧ�����ӷ���ʽ��____________________________________��
��3������ʵ��2��ƽ�Ӷ���ǰӦ���ν��е����ֲ����ǣ���____________����____________��
��4��M��Ʒ��ͭ��������������ѧ����ʽΪ����![]() ��
��![]() ��ʾ����________________________��
��ʾ����________________________��
��5����ʵ����Ҫ![]() ��
��![]() ��Һ
��Һ![]() ����ش��������⣺
����ش��������⣺
������ʱӦ����______![]() ��
��
������![]() ��Һʱ��
��Һʱ��![]() �����к���
�����к���![]() ���ʻᵼ��������ҺŨ��______�����ƫ����ƫС������Ӱ�족����ͬ����
���ʻᵼ��������ҺŨ��______�����ƫ����ƫС������Ӱ�족����ͬ����
��6������ȥʵ��2�е���a��ʹ����������______��ʵ��1����ʵ��ǰ��Bƿ��ˮû��װ����ʹ����������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ���º͵���������������Ϊ��ɫ���壬�������ᣬ������ˮ���Ҵ����ܼ���
(1)ijʵ��С����ѡ������װ�ã����̶ֹ�װ���ԣ��Ʊ��������ƣ���������������˳��Ϊ__________________���������ӿڵ���ĸ��ţ�װ�ÿ��ظ�ʹ�ã���ʵ�鲽�����£��ټ���װ�õ������Ժ�װ��ҩƷ���ڴ�Һ©��������ͨ��һ��ʱ�����壬����ҩƷ���۷�Ӧ������������ƾ��ƣ�����Ӧ����ȴ�����º�ֹͣͨ�����壻�ܲ��װ�ã�ȡ�����ʵ�鲽��۵IJ���Ŀ����______________________��

(2)���÷�ӦCa2++H2O2+2NH3+8H2O=CaO2��8H2O����2NH4+���ڼ��Ի�������ȡCaO2��8H2O��װ�����£�

������C������____________����Ӧ������__________(���������)��ϴ�ӡ����º�ɿɻ��CaO2��8H2O��
��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ_____________��װ��B���ñ�ˮԡ�����¶ȣ������ԭ����______________________________��
�۲ⶨ��Ʒ��CaO2��8H2O�ĺ�����ʵ�鲽�����£�
����һ��ȷ��ȡa g��Ʒ������ƿ�У�������������ˮ������b g KI���壬�ٵ�������2mol/L�����ᣬ��ַ�Ӧ��
���������������ƿ�м��뼸��___________(��ָʾ��)��
����������μ���Ũ��Ϊc mol/L��Na2S2O3��Һ����Ӧ��ȫ���ζ����յ㣬��¼���ݣ����ظ���������2�Σ��ó�����ƽ������Na2S2O3��Һ����ΪVmL����CaO2��8H2O����������Ϊ____���ú���ĸ��ʽ�ӱ�ʾ���� [��֪��I2+2S2O32-=2I-+ S4O62-]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɵ���A�뻯����B���ַ�ĩ��ɵĻ�����һ�������¿ɰ���ͼ��ʾ����ת����

��ش�
(1)A��B�Ļ�ѧʽ�ֱ�Ϊ________��________��
(2)��Ӧ�ٵĻ�ѧ����ʽ��_____________________________________________________��
(3)д����Ӧ�ڢ۵����ӷ���ʽ��
��________________________________________________________________________��
��________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ�ã��ŵ�ʱ�ɽ�Li��CO2ת��ΪLi2CO3��C�����ʱѡ�ú��ʴ�����ʹLi2CO3ת��ΪLi��CO2��O2�������йر�����ȷ����

A. �ŵ�ʱ��Li+��缫X�����ƶ�
B. ���ʱ���缫YӦ�����ֱ����Դ�ĸ�������
C. ���ʱ�������ĵ缫��ӦʽΪC+2Li2CO3��4e��===3CO2��+4Li+
D. �ŵ�ʱ��ÿת��4mol���ӣ�����1molC
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڱ�ϩ��![]() ���Ľṹ�����ʵ���������ȷ���ǣ� ��
���Ľṹ�����ʵ���������ȷ���ǣ� ��
A. �����������ֻ�ѧ������ͬ����
B. �ڹ�������Cl2��Ӧ���ɵ�һ��ȡ��������Ҫ�ǣ� ![]()
C. ��һ����������HCl��Ӧ�ļӳɲ������������
D. �����ʽΪC6H12���л��ﻥΪͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��NaCl��Na2CO3��10H2O��NaHCO3�Ļ���ijͬѧ�������ʵ�飬ͨ��������Ӧǰ��C��Dװ�������ı仯���ⶨ�û�����и���ֵ�����������
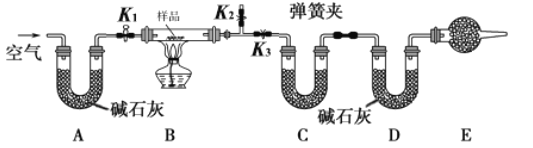
��1���뽫ʵ�鲽�貹������
�ٰ�ͼ���г�����δ��������װ��ʵ��װ�ú����Ƚ��еIJ����� _____________________��
�ڳ�ȡ��Ʒ�����������Ӳ�ʲ������У�������C��Dװ�õ�������
�۴���K1��K2���ر�K3������������������ӣ���Ŀ����____________________��
�ܹرջ���K1��K2����K3����ȼ�ƾ��Ƽ��������ٲ������塣
�ݴ���K1������������������ӣ�Ȼ��ж��װ�ã��ٴγ���C��Dװ�õ�������
��2�����ڸ�ʵ�鷽������ش��������⣺
�������ȷ�Ӧ�����������NaCl�ⶨ�����Ӱ����___________����ƫ��������ƫ����������Ӱ������
��E���������ʢ�ŵ�ҩƷ��_______________����������_____________________________�����ʵ����û�и�װ�ã���ᵼ�²������NaHCO3����������______________����ƫ��������ƫ����������Ӱ������
������Ʒ����Ϊwg����Ӧ��C��Dװ�����ӵ������ֱ�Ϊm1g��m2g���ɴ˿�֪�������Na2CO3��10H2O����������Ϊ______���ú�w��m1��m2�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com