
【题目】下列指定反应的离子方程式正确的是
A.钠与水反应:Na+2H2O===Na++2OH-+H2↑
B.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O ![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C.向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42-===BaSO4↓+H2O
D.向澄清石灰水中加入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-===CaCO3↓+CO32-+2H2O
科目:高中化学 来源: 题型:
【题目】中国化学家研究的一种新型复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是
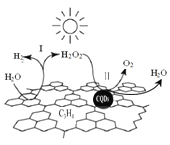
A. C3N4中C的化合价为 -4
B. 反应的两个阶段均为吸热过程
C. 阶段Ⅱ中,H2O2既是氧化剂,又是还原剂
D. 通过该反应,实现了化学能向太阳能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监察局常用“定电位NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示。下列说法不正确的是( )

A.“对电极”是负极
B.“工作电极”上发生的电极反应为NO2+2e-+2H+=NO+H2O
C.传感器工作时H+移向“对电极”
D.“对电极”的材料可能为活泼金属锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金ThNi5可催化反应CO(g)+3H2(g)=CH4(g)+H2O(g),在一定温度下,反应过程中有无催化剂的能量变化如图。下列叙述正确的是

A.使用催化剂时反应的速率主要决定于第②步
B.缩小体积可加快该反应速率,是因为增大了活化分子百分数
C.使用催化剂降低反应的焓变,降低温度有利于产物的生成
D.升高温度,平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸厂的烟气中含有一定量的氮氧化物(NOx),通常要将烟气中的氮氧化物转化为无毒无害的物质即脱硝。
(1)用空气-水脱硝的方法是最经济的方法。
已知:①2NO(g)+O2(g)=2NO2(g)△H1=-123.4kJ·mol-1
②3NO2(g)+H2O(1)=2HNO3(aq)+NO(g)△H2=-73.6kJ·mol-1
写出NO(g)、O2(g)和液体水反应生成HNO3(aq)的热化学方程式______。
(2)吸收电解法是脱硝的种重要方法。先用稀硝酸吸收NOx、反应生成HNO2(一元弱酸),再将吸收液加入电解槽中进行电解,使之转化为硝酸,其电解装置如下图所示。

①图中a应连接电源的________(正极或负极),其电极反应式为_____。
②电解过程中总反应的化学方程式是_____。有10 mol HNO2参加反应.氧化产物的物质的量是_____。
③阴极区产生1mol氮气时,理论上阳极区减少H+的物质的量约为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物邻二乙烯苯广泛用于制造离子交换树脂,其结构简式为![]() ,下列关于邻二乙烯苯的说法正确的是( )
,下列关于邻二乙烯苯的说法正确的是( )
A.1mol 邻二乙烯苯含有5 mol碳碳双键
B.所有的原子不可能在同一平面
C.能发生加成反应,也能发生取代反应,不能发生聚合反应
D.苯环上的二氯取代物有4种(不含立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A 是农药生产中的一种中间体,结构简式如下图所示。下列叙述中正确的是
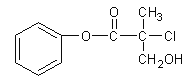
A.1mol A最多能与4mol H2发生加成反应
B.有机物A可以在一定条件下与HBr发生反应
C.有机物A与浓硫酸混合加热,可以发生消去反应
D.1mol A与足量的NaOH溶液反应,最多可以消耗2mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲被誉为“现代工业的维生素”,它在地壳中平均的丰度值很低,铜阳极泥中碲的回收越来越引起人们的重视。某科研小组从粗铜精炼的阳极泥(主要含有 Cu2Te)中提取粗碲设计工艺流程如图所示。下列有关说法正确的是( )
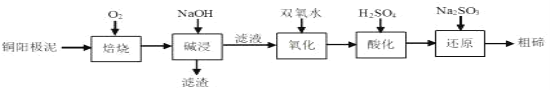
已知: ①“焙烧”后,碲主要以TeO2形式存在
②TeO2微溶于水,易溶于强酸和强碱
A.“焙烧”用到的主要硅酸盐产品仪器:蒸发皿、酒精灯、玻璃棒
B.“还原”时氧化剂与还原剂的物质的量之比为1:2
C.为加快“氧化”速率温度越高越好
D.TeO2是两性氧化物,碱浸时反应的离子方程式为TeO2 +2OH- =TeO32- +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,容积一定的密闭容器中进行可逆反应:X(g)+Y(g)![]() 2Z(g)+W(s) + Q,下列叙述正确的是
2Z(g)+W(s) + Q,下列叙述正确的是
A.加入少量W,υ(逆)增大B.压强不变时,反应达到平衡状态
C.升高温度,υ(逆)、υ(正)都增大D.平衡后加入X,方程式中的Q增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com