
【题目】过氧化尿素是一种新型漂白剂、消毒剂、漂白、消毒的效果优于H2O2和过氧乙酸。某工业用过氧化尿素的部分参数见下表:
分子式 | 外观 | 热分解温度 | 熔点 | 水溶性(20℃) |
CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 500g·L-1 |
合成过氧化尿素的步骤及反应器的示意图如下:在250mL三颈烧瓶中加入一定量的30%的H2O2溶液,再加入30g尿素,在不断搅拌下升温至300℃,使尿素完全溶解,保温30min,冷却至-5℃进行结晶。抽滤得白色粉末状结晶。在50℃下干燥2h,得过氧化尿素产品。回答下列问题:

(1)控制反应温度的适宜方法是__________ (填序号)。
A.酒精灯加热 B.酒精喷灯加热 C.电炉加热 D.水浴加热
(2)反应器中发生反应的化学方程式为___________________________________。
(3)反应器中冷凝管中冷水从______(填“a”或“b”)流进;反应器加热温度不能太高的原因是___________。
(4)搅拌器不能选择铁质或铝质材料的原因是_______________________________________。
(5)为测定产品中活性氧的含量(活性氧16%,相当于含H2O234%),称取干燥样品12.000g,溶解,在250mL 容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1mL6mol·L-1的硫酸,然后用0.2000mol·L-1KMnO4标准溶液滴定(KMnO4溶液与尿素不反应),平行实验三次,实验结果如下:
实验序号 | 1 | 2 | 3 | |
KMnO4溶液体积/mL | 滴定前读数 | 0.00 | 0.00 | 2.00 |
滴定后读数 | 19.98 | 21.70 | 22.02 | |
①KMnO4溶液应盛放在__________滴定管中,滴定终点的现象是_____________。
②产品中活性氧的质量分数为____________。
③若滴定前滴定管尖嘴处无气泡,滴定后有气泡,会使测得的活性氧含量__________(填“偏高”“偏低”或“不变”)。
【答案】 D CO(NH2)2+H2O2=CO(NH2)2·H2O2 b 温度过高会导致过氧化氢分解 铝、铁易被氧化 酸式 滴入最后一滴KMnO4溶液时,溶液显浅红色,且半分钟内不褪色 13.3% 偏低
【解析】试题分析: (1)根据CO(NH2)2·H2O2热分解温度为45℃,分析加热方式;(2)反应器中过氧化氢与尿素发生化合反应生成CO(NH2)2·H2O2;(3) 冷凝管中冷水要低进高出;温度太高,过氧化氢会分解;(4)铁、铝具有还原性,易被氧化;(5)①高锰酸钾具有氧化性,能腐蚀橡胶;H2O2与高锰酸钾溶液反应,使高锰酸钾溶液褪色;②依据2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2;计算过氧化氢物质的量,结合题干信息计算产品中活性氧的质量分数;③依据c标准×V标准=c待测×V待测,根据标准液消耗的多少分析判断;
解析:(1)根据CO(NH2)2·H2O2热分解温度为45℃,所以采用的加热方式应用水浴加热,易于控制温度,选D;(2)反应器中过氧化氢与尿素发生化合反应生成CO(NH2)2·H2O2,反应的化学方程式为CO(NH2)2+H2O2=CO(NH2)2·H2O2;(3) 冷凝管中冷水要低进高出,所以冷凝管中冷水从b流进;过氧化氢加热会分解,所以温度不能太高;(4)铁、铝具有还原性,易被氧化,所以不能选择铁质或铝质材料搅拌器;(5)①高锰酸钾具有氧化性,腐蚀橡胶,KMnO4溶液应盛放在酸式滴定管中;H2O2与高锰酸钾溶液反应,使高锰酸钾溶液褪色,滴定终点的现象是滴入最后一滴KMnO4溶液时,溶液显浅红色,且半分钟内不褪色;②第二次实验明显误差太大,应舍去,第一次和第三次滴定平均消耗KMnO4溶液20.00mL;依据反应2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2;

所以12.000g样品中含过氧化氢0.1mol;过氧化氢质量分数=![]() ×100%=28.3%;活性氧16%,相当于H2O234%,则活性氧质量分数=
×100%=28.3%;活性氧16%,相当于H2O234%,则活性氧质量分数=![]() =13.3%,;③若滴定前滴定管尖嘴处无气泡,滴定后有气泡,消耗高锰酸钾溶液偏小,依据c标准×V标准=c待测×V待测,则过氧化氢物质的量偏小,活性氧含量偏低。
=13.3%,;③若滴定前滴定管尖嘴处无气泡,滴定后有气泡,消耗高锰酸钾溶液偏小,依据c标准×V标准=c待测×V待测,则过氧化氢物质的量偏小,活性氧含量偏低。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某高中化学兴趣小组设计合成高分子材料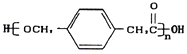
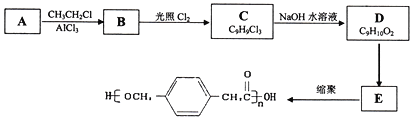
已知:
①A的相对分子质量为92;
②根据结构分析得知同一碳原子上连接两个羟基时结构不稳定,易脱水生成醛或酮;
③D可与新制的氢氧化铜反应;
回答下列问题:
(1)A的结构简式为:___________,B的名称为___________,由B生成C的反应类型是:___________。
(2) 由C生成D的化学方程式为:____________________________,反应过程中生成不稳定的中间产物结构简式为:___________。
(3)写出D转化为E的流程示意图:___________ (示例![]() )
)
(4)E合成高分子材料的化学反应方程式:_________________________________。
(5)E的同分异构体中,满足下列条件的有___________种。
①仅含有苯环,无其他环状结构;
②苯环上只有两个取代基;
③能使三氯化铁溶液显紫色;
④ 含有![]() 的结构;
的结构;
其中核磁共振氢谱表明分子中有六种氢,能发生银镜反应且其峰面积之比为2∶2∶2∶2∶1∶1
请写出其结构简式为:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要制备纯净的氯化钾。现含有少量K2SO4的氯化钾样品,按照如图所示的实验方案进行提纯。

(1)检验加入BaCl2溶液后![]() 是否沉淀完全的操作为____________________________。
是否沉淀完全的操作为____________________________。
(2)若用硝酸钡来代替氯化钡,请判断是否可行,并说明理由:_____________________。
(3)某同学认为该实验方案中加适量氯化钡溶液不容易控制,应加入过量氯化钡溶液,他的思路如下:

请写出①②③④⑤溶质或沉淀的化学式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有34 g 某气体,它的摩尔质量为17g.mol-1。则:
(1)该气体为_____________mol
(2)该气体所含分子数为_________ NA
(3)该气体在标准状况下的体积为_________ L
(4) ________g H2O中的氧原子数目与保准状况22.4LCO2中的氧原子数目相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料生产铝和氮化铝的一种工艺流程如下[已知:SiO2在“碱溶”时转化为铝硅酸钠(NaAlSiO4·nH2O)沉淀]。

(1)操作I、Ⅱ的名称为____________。
(2)用氧化物的形式表示铝硅酸钠的化学式_____________。
(3)杂质Fe2O3最后存在于___________中。
(4)工业制备Al的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Zn(s)+![]() O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
②2Ag(s)+![]() O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为
A. 2Zn(s)+2Ag2O(s)===2ZnO(s)+4Ag(s)ΔH=-634.6 kJ·mol-1
B. Zn+Ag2O===ZnO+2Ag ΔH=+317.3kJ·mol-1
C. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=-317.3kJ
D. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=+317.3kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:aA(g)+bB(g)![]() cC(g)+dD(g)
cC(g)+dD(g)![]() H,学习小组针对反应特点与对应的图象展开了讨论,其中不正确的是
H,学习小组针对反应特点与对应的图象展开了讨论,其中不正确的是

A. 图①中,若p1>p2,则a+b>c+d
B. 图②中,若T2>T1,则![]() H<0且a+b=c+d
H<0且a+b=c+d
C. 图③中,t1时刻改变的条件一定是使用了催化剂
D. 图④中,若![]() H<0,则纵坐标不可能表示反应物的转化率
H<0,则纵坐标不可能表示反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的是( )
A. 7.4 g NH4F和5.6 g C2H4含有的氢原子数均为0.8NA
B. 0.5 L 1 mol/L NaHSO3溶液中含有的HSO3-数目为0.5NA
C. 标准状况下,11.2 L NO2完全溶于水,转移的电子数为0.5NA
D. 在高温高压和催化剂作用的条件下,向一密闭容器中充入28 g N2与足量的H2,充分反应后,转移的电子数为6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com