
ЁОЬтФПЁПTЁцЪБдк2LУмБеШнЦїжаЪЙX(g)гыY(g)ЗЂЩњЗДгІЩњГЩZ(g)ЁЃЗДгІЙ§ГЬжаXЁЂYЁЂZЕФХЈЖШБфЛЏШчЭМ1ЫљЪОЁЃШєБЃГжЦфЫћЬѕМўВЛБфЃЌЮТЖШЗжБ№ЮЊT1КЭT2ЪБЃЌYЕФзЊЛЏТЪгыЪБМфЕФЙиЯЕШчЭМ2ЫљЪОЃЌдђЯТСаНсТлВЛе§ШЗЕФЪЧЃЈ ЃЉ
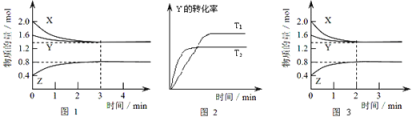
A.ШнЦїжаЗЂЩњЕФЗДгІПЩБэЪОЮЊЃК3X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.ЗДгІНјааЕФЧА3minФкЃЌгУXБэЪОЕФЗДгІЫйТЪv(X)=0.3mol/(LЁЄmin)
C.БЃГжЦфЫћЬѕМўВЛБфЃЌЩ§ИпЮТЖШЃЌЗДгІЕФЛЏбЇЦНКтГЃЪ§KМѕаЁ
D.ШєИФБфЗДгІЬѕМўЃЌЪЙЗДгІНјГЬШчЭМ3ЫљЪОЃЌдђИФБфЕФЬѕМўЪЧЪЙгУДпЛЏМС
ЁОД№АИЁПB
ЁОНтЮіЁП
AЃЎгЩЭМ1жЊЃЌXЕФЮяжЪЕФСПМѕЩйСПЮЊ(2.0-1.4)mol=0.6molЃЌYЕФЮяжЪЕФСПМѕЩйСПЮЊ(1.6-1.4)mol=0.2molЃЌXЁЂYЮЊЗДгІЮяЃЛZЕФЮяжЪЕФСПдіМгСПЮЊ(0.8-0.4)mol=0.4molЃЌZЮЊЩњГЩЮяЃЌЭЌвЛЛЏбЇЗДгІЭЌвЛЪБМфЖЮФкЃЌЗДгІЮяМѕЩйЕФЮяжЪЕФСПКЭЩњГЩЮядіМгЕФЮяжЪЕФСПжЎБШЕШгкЦфМЦСПЪ§жЎБШЃЌЫљвдXЁЂYЁЂZЕФМЦСПЪ§жЎБШ=0.6molЁУ0.2molЁУ0.4mol=3ЁУ1ЁУ2ЃЌЫљвдЗДгІПЩБэЪОЮЊЃК3X(g)+Y(g)2Z(g)ЃЌЙЪAе§ШЗЃЛ
BЃЎЗДгІНјааЕФЧА3minФкЃЌгУXБэЪОЕФЗДгІЫйТЪv(X)= =0.1mol/(LЁЄmin)ЃЌЙЪBДэЮѓЃЛ
=0.1mol/(LЁЄmin)ЃЌЙЪBДэЮѓЃЛ
CЃЎгЩЭМ2жЊЃЌЁАЯШЙеЯШЦНЪ§жЕДѓЁБЃЌЫљвдT2ЃОT1ЃЌЩ§ИпЮТЖШЃЌYЕФзЊЛЏТЪМѕЩйЃЌЦНКтЯђФцЗДгІЗНЯђвЦЖЏЃЌЫљвдЩ§ИпЮТЖШЃЌЦНКтГЃЪ§МѕаЁЃЌЙЪCе§ШЗЃЛ
DЃЎЭМ3гыЭМ1БШНЯЃЌЭМ3ЕНДяЦНКтЫљгУЕФЪБМфНЯЖЬЃЌЫЕУїЗДгІЫйТЪдіДѓЃЌЕЋЦНКтзДЬЌУЛгаЗЂЩњИФБфЃЌЫЕУїВЛЪЧИФБфЮТЖШЕФНсЙћЃЌИУЗДгІе§ЗДгІЪЧЦјЬхЮяжЪЕФСПМѕаЁЕФЗДгІЃЌвВВЛЪЧИФБфбЙЧП(ЛђХЈЖШ)ЕФНсЙћЃЌгІЪЧМгШыДпЛЏМСЕФНсЙћЃЌЙЪDе§ШЗЃЛ
ЙЪбЁBЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈЂёЃЉШчЭМЮЊвЛЁАЬњСДЁБЭМАИЃЌаЁУїдкЭМАИЩЯЗжБ№аДСЫH2ЁЂCO2ЁЂNa2OЁЂNaClЁЂFeCl3ЮхжжЮяжЪЃЌЭМжаЯрСЌЕФСНжжЮяжЪОљПЩЙщЪєЮЊвЛРрЃЌЯрНЛВПЗжAЁЂBЁЂCЁЂDЮЊЦфЯргІЕФЗжРрвРОнДњКХЁЃЧыЛиД№ЯТСаЮЪЬтЃК
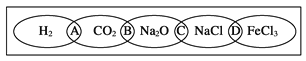
ЃЈ1ЃЉЧыНЋЗжРрвРОнДњКХЬюШыЯргІЕФРЈКХФкЃК
ЃЈ_______________ЃЉСНжжЮяжЪЖМВЛЪЧЕчНтжЪ
ЃЈ________________ЃЉСНжжЮяжЪЖМЪЧбЮ
ЃЈ2ЃЉгУНрОЛЕФЩеБШЁЩйСПеєСѓЫЎЃЌгУОЦОЋЕЦМгШШжСЗаЬкЃЌЯђЩеБжаж№ЕЮМгШыБЅКЭЕФЭМжаФГжжЮяжЪMЕФШмвКМгШШжСГЪКьКжЩЋЁЃ
ЂйЮяжЪMЕФЛЏбЇЪНЮЊ________________ЁЃ
ЂкжЄУїгаКьКжЩЋНКЬхЩњГЩЕФЪЕбщВйзїЪЧ____ЁЃ
ЃЈЂђЃЉЗДгІЃК
AЃЎ2F2ЃЋ2H2OЃН4HFЃЋO2ЁќЃЛ BЃЎ2NaЃЋ2H2OЃН2NaOHЃЋH2ЁќЃЛ
CЃЎCaOЃЋH2OЃНCa(OH)2ЃЛ DЃЎ2H2OЃН2H2ЁќЃЋO2ЁќЁЃ
ЦфжаЫЎжЛЪЧбѕЛЏМСЕФЪЧ______ЃЈЬюађКХЃЉЃЌЗДгІBжаБЛбѕЛЏЕФдЊЫиУћГЦЪЧ________ЁЃ
ЃЈЂѓЃЉЗДгІЃК3Cu + 8HNO3 = 3Cu(NO3)2+2NOЁќ+4H2O, ЯѕЫсдкИУЗДгІжаЕФзїгУЪЧ______ ЛЙдМСгыбѕЛЏМСЕФЮяжЪЕФСПжЎБШЃК__________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЃКЂйR-NO2![]() R-NH2ЃЛЂкБНЛЗЩЯдгаЕФШЁДњЛљЖдаТЕМШыЕФШЁДњЛљНјШыБНЛЗЕФЮЛжУгаЯджјгАЯьЁЃвдЯТЪЧгУБНзїдСЯжЦБИвЛЯЕСаЛЏКЯЮяЕФзЊЛЏЙиЯЕЭМЃК
R-NH2ЃЛЂкБНЛЗЩЯдгаЕФШЁДњЛљЖдаТЕМШыЕФШЁДњЛљНјШыБНЛЗЕФЮЛжУгаЯджјгАЯьЁЃвдЯТЪЧгУБНзїдСЯжЦБИвЛЯЕСаЛЏКЯЮяЕФзЊЛЏЙиЯЕЭМЃК

(1)AзЊЛЏЮЊBЕФЛЏбЇЗНГЬЪНЪЧ______________________________ЁЃ
(2)ЭМжаЁАБНЁњЂйЁњЂкЁБЪЁТдСЫЗДгІЬѕМўЃЌЧыаДГіЂйЂкЮяжЪЕФНсЙЙМђЪНЃКЂй__________ЃЌЂк_______ЁЃ
(3)БНЕФЖўТШДњЮяга________жжЭЌЗжвьЙЙЬхЁЃ
(4)гаЛњЮя ЕФЫљгадзг________(ЬюЁАЪЧЁБЛђЁАВЛЪЧЁБ)дкЭЌвЛЦНУцЩЯЁЃ
ЕФЫљгадзг________(ЬюЁАЪЧЁБЛђЁАВЛЪЧЁБ)дкЭЌвЛЦНУцЩЯЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаAЁЂBЁЂCЁЂDЁЂEЮхжждЊЫиЃЌЦфжаAЁЂBЁЂCЪєгкЭЌвЛжмЦкЃЌAдзгзюЭтВуpФмМЖЕФЕчзгЪ§ЕШгкДЮЭтВуЕФЕчзгзмЪ§ЁЃBдЊЫиПЩЗжБ№гыAЁЂCЁЂDЁЂEЩњГЩRB2аЭЛЏКЯЮяЃЌВЂжЊдкDB2КЭEB2жаЃЌDгыBЕФжЪСПБШЮЊ7ЃК8ЃЌEгыBЕФжЪСПБШЮЊ1ЃК1ЁЃИљОнвдЩЯЬѕМўЃЌЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЭЦЖЯCЁЂDЁЂEдЊЫиЗжБ№ЪЧ(гУдЊЫиЗћКХЛиД№)ЃКC____ЃЌD___ЃЌE___ЁЃ
ЃЈ2ЃЉаДГіDдзгЕФЕчзгХХВМЪН____ЁЃ
ЃЈ3ЃЉаДГіAдЊЫидкBжаЭъШЋШМЩеЕФЛЏбЇЗНГЬЪН_____ЁЃ
ЃЈ4ЃЉжИГіEдЊЫидкдЊЫижмЦкБэжаЕФЮЛжУ____ЁЃ
ЃЈ5ЃЉБШНЯAЁЂBЁЂCШ§жждЊЫиЕФЕквЛЕчРыФмЕФДѓаЁЫГађ___(АДгЩДѓЕНаЁЕФЫГађХХСа,гУдЊЫиЗћКХБэЪО)ЁЃ
ЃЈ6ЃЉБШНЯдЊЫиDКЭEЕФЕчИКадЕФЯрЖдДѓаЁ___ЁЃ(АДгЩДѓЕНаЁЕФЫГађХХСаЃЌгУдЊЫиЗћКХБэЪО)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЕчзгЙЄвЕжагУЙ§СПЕФFeCl3ШмвКШмНтЕчТЗАхжаЕФЭВЪБЃЌЛсВњЩњДѓСПЗЯвКЁЃгЩИУЗЯвКЛиЪеЭВЂЕУЕНОЛЫЎМСЃЈFeCl36H2OЃЉЕФВНжшШчЯТЃК
I.дкЗЯвКжаМгШыЙ§СПЬњЗлЃЌЙ§ТЫЃЛ
II.ЯђIЕФТЫдќжаМгШыЙ§СПЪдМСAЃЌГфЗжЗДгІКѓЃЌЙ§ТЫЃЌЕУЕНЭЃЛ
III.КЯВЂIКЭIIжаЕФТЫвКЃЌЭЈШызуСПТШЦјЃЛ
IV.ЁЁЃЌЕУЕНFeCl36H2OОЇЬхЁЃ
ЃЈ1ЃЉгУFeCl3ШмвКИЏЪДЭВЕФРызгЗНГЬЪНЪЧ_____________ЃЛ
ЃЈ2ЃЉЪдМСAЪЧ______ЃЛ
ЃЈ3ЃЉШЁЩйСПВНжшIIIЫљЕУЕФШмвКгкЪдЙмжаЃЌФмЙЛжЄУїЭЈШыТШЦјзуСПЕФЪЧ______ЃЛ
a. МьбщCl2ЕФДцдк b. МьбщFe3+ЕФДцдк c. МьбщFe2+ЕФВЛДцдк
ЃЈ4ЃЉЭъГЩВНжшIVашвЊгУЕНЕФЪЕбщзАжУЪЧ______ЃЈЬюзжФИЃЉЁЃ
a b
b c
c d
d
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаМзЁЂввСНИіЭъШЋЯрЭЌЕФзАжУЃЌЗжБ№дкЫќУЧЕФВрЙмжазАШы1.06g Na2CO3КЭ0.84g NaHCO3ЃЌЪдЙмжаИїга10mLЯрЭЌХЈЖШЕФбЮЫсЃЈШчЭМЃЉЃЌЭЌЪБНЋСНИіВрЙмжаЕФЮяжЪШЋВПЕЙШыИїздЕФЪдЙмжаЃЌЯТСаа№Ъіе§ШЗЕФЪЧ
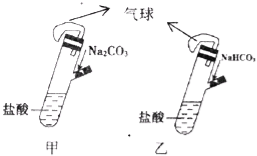
A. МззАжУЕФЦјЧђХђеЭЫйТЪДѓ
B. ШєзюжеСНЦјЧђЬхЛ§ЯрЭЌЃЌдђвЛЖЈгаcЃЈHClЃЉЁн2 mol/L
C. ШєзюжеСНЦјЧђЬхЛ§ВЛЭЌЃЌдђвЛЖЈгаcЃЈHClЃЉЁм1 mol/L
D. зюжеСНШмвКжаNa+ЁЂClЉЕФЮяжЪЕФСПЯрЭЌ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГПЮЭтаЁзщЭЌбЇЩшМЦШчЭМЪЕбщзАжУЃЈВПЗжМаГжвЧЦїЮДЛГіЃЉЬНОПАБЦјЕФЛЙдадВЂМьбщВПЗжВњЮяЁЃ
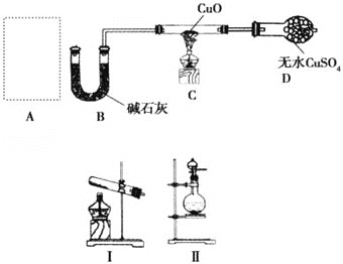
ЃЈ1ЃЉШєAжаЪЙгУзАжУЂёжЦШЁАБЦјЃЌдђЛЏбЇЗНГЬЪНЮЊ__ЃЌЗЂЩњзАжУЪдЙмПкТдЯђЯТЧуаБЕФдвђ_____ЃЛШєAжаЪЙгУзАжУЂђжЦШЁАБЦјЃЌдђЗжвКТЉЖЗжаЕФЪдМСЮЊ__ЃЌдВЕзЩеЦПжаЕФЙЬЬхПЩвдЮЊ__ЁЃ
ЃЈ2ЃЉBжаМюЪЏЛвЕФзїгУЪЧ__ЁЃ
ЃЈ3ЃЉАБЦјЛЙдГуШШбѕЛЏЭЕФЛЏбЇЗНГЬЪНЮЊ__ЃЌзАжУCжаЕФЪЕбщЯжЯѓЮЊ__ЃЌзАжУDжаЕФЪЕбщЯжЯѓЮЊ__ЁЃ
ЃЈ4ЃЉЂйИУзАжУДцдкУїЯдЕФШБЯнЪЧ__ЁЃ
ЂкЧыЛГіИФНјКѓашвЊдіМгСЌНгЕФЪЕбщзАжУЭМ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП(1)Аб7.8gУОТСКЯН№ЕФЗлФЉЗХШыЙ§СПЕФбЮЫсжаЃЌЕУЕН8.96 LH2ЃЈБъзМзДПіЯТЃЉЁЃИУКЯН№ШмгкзуСПNaOHШмвКЃЌВњЩњH2ЕФЬхЛ§ЃЈБъзМзДПіЯТЃЉЮЊ____________ ЁЃ
(2)ЯрЭЌЬѕМўЯТЃЌФГCl2гыO2ЛьКЯЦјЬх75mLЧЁКУгы100mL H2ЛЏКЯЩњГЩHClКЭH2OЃЌдђЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПЮЊ____________ЁЃ
(3)СНИіЯрЭЌШнЛ§ЕФУмБеШнЦїXЁЂYЃЌдк25 ЁцЯТЃЌXжаГфШыa g AЦјЬхЃЌYжаГфШыa g CH4ЦјЬхЃЌXгыYФкЕФбЙЧПжЎБШЪЧ2ЃК5ЃЌдђAЕФФІЖћжЪСПЮЊ____________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗжзгжаЕФЫљгаЬМдзгВЛПЩФмдкЭЌвЛЦНУцЩЯЕФЪЧЃЈ ЃЉ
A. 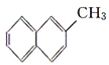 B.
B. 
C.  D.
D. ![]()
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com