
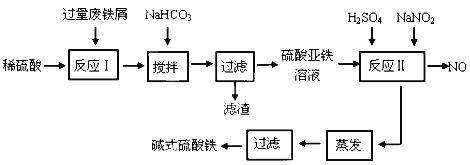
����Ŀ����ʽ������[Fe(OH)SO4]��һ��������ˮ����������Ч����������ҽҩ��Ҳ���������������������Ѫ����ҵ�����÷���м�����������������������ȣ�������ʽ�������Ĺ����������£�
��֪������������������������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
��ʼ���� | 2.3 | 7.5 | 3.4 |
��ȫ���� | 3.2 | 9.7 | 4.4 |
��ش��������⣺
��1����������NaHCO3��Ŀ���ǵ���pH��Χ��__________________________����ʹ��Һ�е�___________________����(д���ӷ���)���÷�Ӧ�����ӷ���ʽΪ_________________________________ ��
��2����Ӧ���е����ӷ���ʽΪ________________________________________________ ��
��3����ʵ�������У���Ӧ����ͬʱͨ��O2�Լ���NaNO2�������������뷴Ӧ��O2��11.2 L����״���������൱�ڽ�ԼNaNO2�����ʵ���Ϊ_____________________��
��4����ʽ����������ˮ�������Fe(OH)2+���ӣ�Fe(OH)2+�ɲ���ˮ������Fe2(OH)42+ �ۺ����ӣ���ˮ�ⷴӦ�����ӷ���ʽΪ___________________________________��
��5����ҽҩ�ϳ�����������������������Ļ��Һ��Ӧ�Ʊ���ʽ�������������ҹ�����������Ʒ�в��ú���Fe2+��NO3����Ϊ�������ò�Ʒ���Ƿ���Fe2+��Ӧʹ�õ��Լ�Ϊ___________________��
A����ˮ B��KSCN��Һ C��NaOH��Һ D������KMnO4��Һ
���𰸡�4.4-7.5 Al3+ Al3+ + 3OH- = Al(OH)3�� Fe2+��2H+��NO2- = Fe3+�� H2O��NO�� 2mol 2Fe(OH)2+��2H2O![]() Fe2(OH)42+��2H+ D
Fe2(OH)42+��2H+ D
��������
��1��Ҫ�Ʊ�����������Ӧ�����������룬���ݳ�����pHѡ��Χ�����ݳ�����Ӧ��д���ӷ���ʽ��
��2�����̷�����Ӧ������������������Һ��������������Ϊ�����ӣ�����������ԭ��Ӧ�����غ�������غ��ԭ���غ���ƽд����
��3�������������õ��ĵ��ӵ����ʵ����൱��NaNO2�õ����ӵ����ʵ�����
��4�����ݷ�Ӧ����������ж����ӷ���ʽ��
��5��֤������������������Ҫѡ����������Һ��ɫ������ʵ����֤��
��1�����ݲ���������������������ʽ����ʱ��Һ��pH��Al(OH)3��ȫ������pHҪ�ﵽ4.4����Fe(OH)2��ʼ������pHΪ7.5����Һ�к�Fe2+��Al3+��Ϊ��ʹAl3+�γɳ�����ȥ����Ӱ��Fe2+������pH��4.4--7.5 ��Χ�����ò�����Ŀ����ʹAl3+�������÷�Ӧ�����ӷ���ʽΪAl3+ + 3OH- = Al(OH)3����
��ˣ�������ȷ��Ϊ��4.4-7.5 ��Al3+ ��Al3+ + 3OH- = Al(OH)3����
��2���������ξ��������ԣ��������������ܰ����������������������ӣ���Ӧ�����ӷ���ʽΪ2H+ + Fe2++ NO2- ��Fe3+ + NO��+ H2O��
��ˣ�������ȷ��Ϊ��Fe2+��2H+��NO2- = Fe3+�� H2O��NO����
��3�����������ʵ�����11.2L��22.4L/mol��0.5mol����õ�����0.5mol��4��2mol��1molNaNO2����ԭ����NO�����ϼ���+3�۽��͵�+2�ۣ��õ�1mol���ӣ�����Ҫ2molNaNO2��
��ˣ�������ȷ��Ϊ��2mol��
��4��Fe(OH)2+���ӣ��ɲ���ˮ������Fe2(OH)42+�ۺ����ӣ����ݵ���غ�������غ��д����Ӧ�����ӷ���ʽΪ2Fe(OH)2+ +2H2O![]() Fe2(OH)42+ + 2H+��
Fe2(OH)42+ + 2H+��
��ˣ�������ȷ��Ϊ��2Fe(OH)2+��2H2O![]() Fe2(OH)42+��2H+��
Fe2(OH)42+��2H+��
��5��A����ˮ����������������Ϊ�����ӣ���Һ��ɫ�仯�����ԣ����ܼ����������ӣ���A�����ϣ�
B��KSCN��Һ���������Ӳ���Ӧ��������������B�����ϣ�
C��NaOH��Һ����������ӷ�Ӧ���ɺ��ɫ�������ܼ����Ƿ�����������ӣ���C�����ϣ�D������KMnO4��Һ�����������Ӹ��������Һ��ɫ����D���ϣ�
��ˣ�������ȷ��Ϊ��D��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������
��NaHCO3��Һ��ˮϡ�ͣ�c(Na+)/ c(HCO3��)�ı�ֵ��������
��Ũ�Ⱦ�Ϊ0.1 mol��L��1��Na2CO3��NaHCO3�����Һ��2c(Na+)=3[c(CO![]() )+c(HCO
)+c(HCO![]() )]
)]
����0.1 mol��L��1��ˮ�еμ�0.lmol��L��1���ᣬǡ����ȫ�к�ʱ��Һ��pH=a������ˮ���������c(OH��)=l0��amol��L��1
����0.1mol/LNa2SO3��Һ�м�������NaOH���壬c��Na+����c��SO32����������
����Na2Sϡ��Һ�У�c(H+)=c(OH��)+c(H2S)+c��HS����
A. �٢� B. �ڢ� C. �٢� D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ǹ�ҵ������Ҫԭ�ϣ�Ҳ�Ǵ�����Ⱦ����Ҫ��Դ���о�������������ط�Ӧԭ��������Ҫ���塣�ش��������⣺
��1��һ����ɵķ�Ӧ��Ϊ��Ԫ��Ӧ��ֻ�ɻ�Ԫ��Ӧ���ɵĻ�ѧ��Ӧ��Ϊ��Ӧ�����������ϻ�Ԫ��Ӧ���ɵĻ�ѧ��Ӧ��Ϊ���ӷ�Ӧ�����ӷ�Ӧ������ȡ�����ȣ������Ļ�Ԫ��Ӧ���ʡ���Ԫ��ӦaA+bB=cC+dD�����ʷ���Ϊv=k��ca(A)��cb(B)������kΪ���ʳ�������֪��ӦNO2+CO=NO+CO2 ���ڲ�ͬ�¶��·�Ӧ������ͬ��
���¶ȸ���490Kʱ��������ӦΪ��Ӧ����д�������ʷ���______________��
���¶ȸ���520Kʱ���÷�Ӧ����������Ԫ��Ӧ���ɵĸ��ӷ�Ӧ�������ʷ���v=k��c2(NO2)����֪���Ļ�Ԫ��Ӧ�ķ�Ӧ��Ͳ���ΪNO��NO2 ��NO3���÷���ʽ��ʾ��Ӧ���̡�
��һ����____________________������Ӧ����
�ڶ�����____________________���췴Ӧ����
��2��N2O4(g) ![]() 2NO2(g) ��H =+57 kJ��mol��1 �÷�Ӧ�Ǹ��кʹ�ѧ��ѧѧϰ�ľ����زġ�
2NO2(g) ��H =+57 kJ��mol��1 �÷�Ӧ�Ǹ��кʹ�ѧ��ѧѧϰ�ľ����زġ�
�ٶ���������Ӧ����˵������ȷ��һ����_________������ĸ����
A�����º��ݣ�����N2O4���´ﵽƽ����ϵ��ɫ����
B�����º��ݣ�����NO2���´ﵽƽ��NO2����������
C�����������У���ϵ��ɫ���䣬˵���÷�Ӧ����ƽ��״̬
D. ���º�ѹ�£�����N2O4���´ﵽƽ����ϵ��ɫ����
��T1Kʱ����1L��������м���1molN2O4 ���ﵽƽ��ʱNO2��ƽ�����Ϊ20%������¶��µ�ƽ�ⳣ��K=____,�ﵽƽ��ʱ���յ�����Ϊ_____kJ��ij�¶��£��÷�Ӧ�ﵽƽ�⣬NO2��N2O4�Ļ��������ѹǿΪ100KPa���ܶ�Ϊͬ״̬�������ܶȵ�34.5����ƽ�ⳣ��KP=____KPa����ƽ���ѹ����ƽ��Ũ�ȼ��㣩��
����v(N2O4)=k1��c(N2O4) v(NO2)=k2��c(NO2)��T2�¶��£���k1=k2 ����T2____T1��������������������������
��3�����ӷ�Ӧ2NO(g)+O2(g)=2NO2(g)��������Ԫ��Ӧ���ɣ�2NO(g)=N2O2(g) ������ƽ�⣩N2O2(g) +O2(g)=2NO2(g)������Ӧ������֪�췴ӦΪ���ȷ�Ӧ���������淴Ӧ���ʳ����ֱ�Ϊk1��k2����Ӧ�����淴Ӧ���ʳ����ֱ�Ϊk3��k4����v��=k��c2(NO)��c(O2) ��k=______����k1��k2��k3��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�2���绯ѧװ�õ�������ȷ����

A. װ�â��У������ƶ���·���ǣ�Zn��Cu��CuSO4��Һ��KCl���š�ZnSO4��Һ
B. �ڲ��ı��ܷ�Ӧ��ǰ���£�װ�âٿ���Na2SO4�滻ZnSO4����ʯī�滻Cu��
C. װ�â��в���ʯī�缫��ͨ�������OH��������Ǩ�ƣ�������������pH����
D. ��װ�â�����������ͭ����N��Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����վ��װ��һ̨ȼ�ϵ�أ��õ�ؿ�ͬʱ�ṩ���ˮ����������ȼ��Ϊ�����������Ϊ���ڵ�̼��ء���֪��ص��ܷ�ӦΪ2H2+O2=2H2O��������ӦΪ![]() ������˵����ȷ����
������˵����ȷ����
A.�õ�ؿ��ڳ��»����ʱ����
B.������ӦΪ![]()
C.�õ�ع���ʱ������CO2����
D.�����ϸõ�ع�Ӧ1molH2O��ͬʱ������ת��2mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. ���ǻ�����ȩ�ķе�ȶ��ǻ�����ȩ�ĸ�
B. ��̬̼ԭ�ӵ����������Ų�ͼ:![]()
C. ԭ�Ӻ���۵����Ų�ʽ�ֱ�Ϊ3s1��3s23p5����Ԫ�أ������γ�AB2�ͻ�����
D. ԭ�Ӻ�������Ų�ʽΪ1s2��ԭ����ԭ�Ӻ�������Ų�ʽΪ1s22s2��ԭ�ӻ�ѧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�ӦH2��g��+I2��g��![]() 2HI��g��
2HI��g�� ![]() H<0������˵����ȷ����
H<0������˵����ȷ����
A. ��Ӧ�ﵽƽ�����С����������������ƽ����Է���������С
B. ��Ӧ�ﵽƽ����������¶Ⱥ�������䣬����HI���壬�ٴδﵽƽ�⣬H2ת���ʼ�С��ƽ�ⳣ��Kֵ��С
C. ��v����H2��=2v����HI������Ӧ�ﵽƽ��״̬
D. ��Ӧ�ﵽƽ���������������䣬���£���Ӧ��ϵ����ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ҹ��Ϻ��������������ڴ����Ŀ�ȼ������Ȼ��ˮ����ɱ�ʾΪ![]() ����
����
2017��5�£��й��״κ����ȼ���Բɳɹ���2017��11��3�գ�����Ժ��ʽ������ȼ����Ϊ�¿��֡���ȼ���Ŀ��ɺ����ã��������ڽ���������ٵ���ԴΣ������������һϵ�еĹ�ҵ��Ʒ��
(1)��ij��ȼ���������ж���������ȡһ������Ʒ���ͷų��ļ�����������ۺϳɱ�״����Ϊ166 m3��ʣ�� H2O �����Ϊ0.8m3�������Ʒ�Ļ�ѧʽ�� x=_________________��
(2)��֪�±����ݣ���֪ H2O(l)=H2O(g) ��H=+41![]()
��ѧ�� | C��H | O=O | C=O | H��O |
����/ | 413 | 498 | 803 | 463 |
�ü���ȼ���ȱ�ʾ���Ȼ�ѧ����ʽΪ_____________________________________________________��
(3)����ȼ�ϵ�������ֱ��ȼ�ռ������Ÿ��ߵ�����ת��Ч�ʣ�ij����ȼ�ϵ�أ�����ͨ���������ij�ֽ���������Ϊ���ӵ��壨�������ӿ�Ѩ���ܴ��� O2-�����õ�ظ����ĵ缫��ӦʽΪ__________________________________________��
(4)������ˮ�������������ǹ�ҵ�ϻ����������Ҫ�ֶΡ�������������ˮ��һ�������·�Ӧ����H2��ͬʱ�õ������Ϊ1:3��CO2��CO���÷�Ӧ�Ļ�ѧ����ʽΪ_____________________________________����������е�CO2����Ũ��ˮ�ѳ���ͬʱ��õ���NH4HCO3���÷�Ӧ�����ӷ���ʽ��_________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״̬�£���̬���ӶϿ�1 mol��ѧ�����ʱ��Ϊ���ʡ���֪H��H��H��O��O===O���ļ�����H�ֱ�Ϊ436 kJ��mol��1��463 kJ��mol��1��495 kJ��mol��1�������Ȼ�ѧ����ʽ��ȷ����
A. H2O(g)===H2��1/2O2(g)��H����485 kJ��mol��1
B. H2O(g)===H2(g)��1/2O2(g) ��H����485 kJ��mol��1
C. 2H2(g)��O2(g)===2H2O(g) ��H����485 kJ��mol��1
D. 2H2(g)��O2(g)===2H2O(g) ��H����485 kJ��mol��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com