
【题目】下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO![]() )+c(HCO
)+c(HCO![]() )]
)]
③在0.1 mol·L-1氨水中滴加0.lmol·L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=l0-amol·L-1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+c(H2S)+c(HS-)
A. ①④ B. ②⑤ C. ①③ D. ②④
【答案】B
【解析】试题①NaHCO3溶液加水稀释,HCO3-水解程度增大,所以c(Na+)、c(HCO3-)都减小,减小的倍数:c(Na+)<c(HCO3-),故c(Na+)/c(HCO3-)的比值保持增大,正确;②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液,根据物料守恒可得2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],错误;③在0.1 mol·L-1氨水中滴加0.lmol·L-1盐酸,恰好完全中和时反应产生NH4Cl,该盐是强酸弱碱盐,在溶液中NH4+水解消耗OH-,产生H+,使溶液中c(H+)增大,若溶液的pH=a,则由水电离产生的c(H+)=l0-amol/L,正确;④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,会对SO32-的水解平衡起抑制作用,故c(SO32-)增大,由于加入了NaOH固体,所以c(Na+)也增大,正确;⑤在Na2S稀溶液中,根据质子守恒可得c(OH-) = c(H+) +c(H2S)+c(HS-),错误。故错误的是②⑤,选项B符合题意。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
【题目】某实验小组同学进行如下实验,以检验化学反应中的能量变化。请回答下列问题:
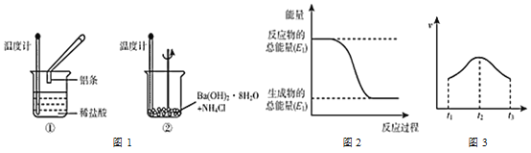
(1)实验中发现,反应后①中的温度___,②中的温度___。(填“升高”或“降低”)
(2)上述反应过程中的能量变化可用图2表示的是___(填“①”或“②”)。
(3)实验①中测得产生气体的速率与时间的关系如图3所示,则t2-t3反应速率逐渐小的主要原因是___;
(4)写出①中发生反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应M+Z→Q(△H<0)分两步进行:①M+Z→X(△H>0),②X→Q(△H<0).下列示意图中,能正确表示总反应过程中能量变化的是( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以有机物A、E为原料,制备聚酯纤维M和药物中间体N的一种合成路线如下:

已知:①A的核磁共振氢谱有3组吸收峰
②
③
请回答下列问题:
(1)A的化学名称为_______。
(2)B→C、G→H的反应类型分别为_________、_________。
(3)关于E的说法正确的是_____(填选项字母)。
A.分子中含有碳碳双键 B.所有原子均在同一平面上
C.邻二氯代物有两种结构 D.能使酸性KMnO4溶液褪色
(4)D+I→M的化学方程式为_____________。
(5)J的结构简式为____________。
(6)同时满足下列条件的N(C8H12O3)的同分异构体有______种(不考虑立体异构)。
①饱和五元碳环上连有两个取代基 ②能与NaHCO3溶液反应 ③能发生银镜反应
(7)参照上述合成路线和信息,以环庚醇和甲醇为有机原料(无机试剂任选),设计制备 的合成路线________。
的合成路线________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱法是中国传统工业方法,此方法制备Na2CO3一直在工业上沿用至今。其原理如下:①NH3+H2O+CO2=NH4HCO3
②NH4HCO3+NaCl=NH4Cl+NaHCO3↓
③2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
Ⅰ.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用如图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。

(1)装置丙中反应的化学方程式为____。
(2)装置乙的作用是___。为防止污染空气,尾气中的___需要进行吸收处理。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有___。
Ⅱ.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

选择的装置(填编号) | 实验现象 | 实验结论 |
___ | ___ | 样品中含NaHCO3 |
(5)测定该纯碱样品的纯度:称取m1g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为m2g。则该纯碱样品的纯度为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对室温下c(H+)相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
A. 加适量的醋酸钠晶体后,两溶液的c(H+)均减小
B. 使温度都升高20℃后,两溶液的c(H+)均不变
C. 加水稀释2倍后,两溶液的c(H+)均增大
D. 加足量的锌充分反应后,两溶液中产生的氢气一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 光照新制的氯水时,溶液的c(H+)逐渐增大
B. 对CO(g)+NO2(g)![]() CO2(g)+NO(g),平衡体系增大压强可使颜色变深
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C. 升高温度能够促进水的电离
D. 在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2S02(g)+02(g) ![]() 2S03(g) △H <0。请回答下列问题:
2S03(g) △H <0。请回答下列问题:
(1)某温度下,在一固定体积的密闭容器中加入100g SO3(g)发生上述反应,下列能说明该反应已达到平衡状态的是_____(填序号)
①每生成80g S03的同时消耗64gSO2
②混合气体的密度保持不变
③SO3的体积分数保持不变
④混合气体的平均相对分子质量不再变化
(2)某温度下,在一固定体积为2升的密闭容器中,充入2molS02和lmol02发生上述反应,当反应进行到2分钟末时达到平衡,平衡混合物中S03的质量分数为50%,则反应前2分钟内用S02表示的平均反应速率为_____,S02的转化率为____,此时反应的平衡常数为_________。
(3)在某恒温、恒压容器中,按体积比2: 1加入S02和02进行上述反应,达到平衡后,再向容器中充入适量S03(g),达到新平衡时,c(02)将比原平衡_____(填“增大”、“减小”、或“不变”)
(4)若在某恒温、恒容容器中,加入一定量S03(g)发生上述反应,达到平衡后,再向容器 中充入适量S03(g),达到新平衡时,c(S02)/c(S03)将比原平衡______(填“增大”、“减小”、或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
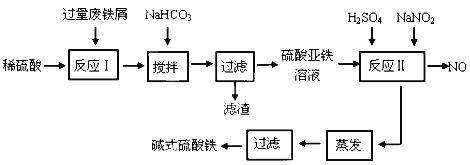
【题目】碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
请回答下列问题:
(1)加入少量NaHCO3的目的是调节pH范围在__________________________内,使溶液中的___________________沉淀(写离子符号),该反应的离子方程式为_________________________________ 。
(2)反应Ⅱ中的离子方程式为________________________________________________ 。
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为_____________________。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为___________________________________。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为___________________。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com