
【题目】下列事实不能用勒夏特列原理解释的是
A. 光照新制的氯水时,溶液的c(H+)逐渐增大
B. 对CO(g)+NO2(g)![]() CO2(g)+NO(g),平衡体系增大压强可使颜色变深
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C. 升高温度能够促进水的电离
D. 在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
【答案】B
【解析】
勒夏特利原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒夏特利原理适用的对象应存在可逆过程,如与可逆过程的平衡移动无关,则不能用勒夏特利原理解释。
A、氯水中存在化学平衡Cl2+H2OHCl+HClO,光照使氯水中的次氯酸分解,次氯酸浓度减小,使得平衡向右移动,氢离子浓度变大,溶液的pH值减小,能用勒夏特列原理解释,故A不符合;
B、对平衡CO(g)+NO2(g)CO2(g)+NO(g),两边气体计量数相等,增大压强平衡不移动,不能用勒夏特列原理解释,故B符合;
C、水的电离是吸热的过程,升高温度,化学平衡正向进行,和平衡有关,故C不符合;
D、Fe3++SCN-Fe(SCN)2+,向溶液中加入Fe粉,发生反应Fe+2Fe3+=3Fe2+,平衡向逆反应方向移动,导致溶液颜色变浅或褪去,可以用勒夏特里原理解释,故D不符合。
故选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.lmol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是__________
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(2)取10mL乙溶液,加入等体积水,醋酸的电离平衡___________(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体 (假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将___________(填“增大”“ 减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)___________V(乙) (填“>”、“ <”或“=”)。
(4)已知25℃时,两种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数K1 | 1.8×l1-5 | 4.3×l0-7 | 3.0×10-8 |
K2 | - - | 5.6×10-11 | - - |
下列四种离子结合H+能力最强的是___________;
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=___________;取99mL甲溶液与lrnLlmol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( )

A. NaHB溶液可能为酸性,也可能为碱性
B. A、B、C三点溶液的pH是逐渐减小,D、E、F三点溶液的pH是逐渐增大
C. E溶液中离子浓度大小关系:c(NH4+)>c(B2-)>c(OH-)>c(H+)
D. F点溶液c(NH4+)=2c(B2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
①NaHCO3溶液加水稀释,c(Na+)/ c(HCO3-)的比值保持增大
②浓度均为0.1 mol·L-1的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO![]() )+c(HCO
)+c(HCO![]() )]
)]
③在0.1 mol·L-1氨水中滴加0.lmol·L-1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=l0-amol·L-1
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+c(H2S)+c(HS-)
A. ①④ B. ②⑤ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度不是1 mol/L的是( )
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 将80 g SO3溶于水并配成1 L的溶液
C. 将0.5 mol/L的NaNO3溶液100 mL加热蒸发掉50 g水的溶液
D. 标况下,将22.4 L氯化氢气体溶于水配成1 L溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前手机屏幕主要由保护玻璃、触控层以及下面的液晶显示屏三部分组成。下面是工业上用丙烯(A)和有机物C(C7H6O3)为原料合成液晶显示器材料(F)的主要流程:

(1)化合物C的结构简式为_____。B的官能团名称_____。
(2)上述转化过程中属于取代反应的有______(填反应序号)。
(3)写出B与NaOH水溶液反应的化学方程式_________。
(4)下列关于化合物D的说法正确的是_____(填字母)。
a.属于酯类化合物 b.1molD最多能与4molH2发生加成反应
c.一定条件下发生加聚反应 d.核磁共振氢谱有5组峰
(5)写出符合下列条件下的化合物C的同分异构体的结构简式______。
①苯环上一溴代物只有2种 ②能发生银镜反应 ③苯环上有3个取代基
(6)请参照上述制备流程,写出以有机物C和乙烯为原料制备 的合成路线流程图(无机试剂任用)_______。
的合成路线流程图(无机试剂任用)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定温度下,某容积为2 L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如右图,依图所示:
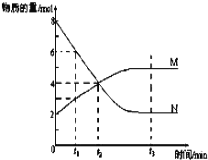
(1)该反应的化学方程式是____________________________。
(2)在图上所示的三个时刻中,_______(填t1、t2或t3)时刻达到化学反应限度。
II.一定温度下将6 mol A及6 mol B混合于2 L的密闭容器中,
发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
xC(g)+2D(g),经过5分钟后反应达到平衡,测得A的转化率为60%,C的平均反应速率是0.36 mol/(L·min)。求:
(1)平衡时D的浓度=___________________。
(2)B的平均反应速率υ(B)= ___________________________。
(3)x=_________。
(4)开始时容器中的压强与平衡时的压强之比为______________(化为最简整数比)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化合物是工业生产重要原料,也是大气污染的重要来源,研究氮氧化合物相关反应原理具有重要意义。回答下列问题:
(1)一步完成的反应称为基元反应,只由基元反应构成的化学反应称为简单反应,两个及以上基元反应构成的化学反应称为复杂反应,复杂反应的速率取决(等)于慢的基元反应速率。基元反应aA+bB=cC+dD的速率方程为v=k·ca(A)·cb(B),其中k为速率常数。已知反应NO2+CO=NO+CO2 ,在不同温度下反应机理不同。
①温度高于490K时,上述反应为简单反应,请写出其速率方程______________。
②温度高于520K时,该反应是由两个基元反应构成的复杂反应,其速率方程v=k·c2(NO2),已知慢的基元反应的反应物和产物为NO、NO2 、NO3,用方程式表示反应历程。
第一步:____________________(慢反应)。
第二步:____________________(快反应)。
(2)N2O4(g) ![]() 2NO2(g) ΔH =+57 kJ·mol-1 该反应是高中和大学化学学习的经典素材。
2NO2(g) ΔH =+57 kJ·mol-1 该反应是高中和大学化学学习的经典素材。
①对于上述反应下列说法不正确的一项是_________(填字母)。
A.恒温恒容,加入N2O4重新达到平衡体系颜色加深
B.恒温恒容,加入NO2重新达到平衡NO2体积分数变大
C.绝热容器中,体系颜色不变,说明该反应处于平衡状态
D. 恒温恒压下,加入N2O4重新达到平衡体系颜色不变
②T1K时,向1L真空容器中加入1molN2O4 ,达到平衡时NO2的平衡产率为20%,则该温度下的平衡常数K=____,达到平衡时吸收的热量为_____kJ。某温度下,该反应达到平衡,NO2与N2O4的混合气体总压强为100KPa,密度为同状态下氢气密度的34.5倍,平衡常数KP=____KPa(用平衡分压代替平衡浓度计算)。
③若v(N2O4)=k1·c(N2O4) v(NO2)=k2·c(NO2),T2温度下,若k1=k2 ,则T2____T1(填“高于”或“低于”)。
(3)复杂反应2NO(g)+O2(g)=2NO2(g)由两个基元反应构成,2NO(g)=N2O2(g) (快速平衡)N2O2(g) +O2(g)=2NO2(g)(慢反应),已知快反应为放热反应,其正、逆反应速率常数分别为k1和k2慢反应正、逆反应速率常数分别为k3和k4。若v正=k·c2(NO)·c(O2) 则k=______(用k1、k2、k3表示);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应H2(g)+I2(g)![]() 2HI(g)
2HI(g) ![]() H<0,下列说法正确的是
H<0,下列说法正确的是
A. 反应达到平衡后,缩小容器体积,混合气体平均相对分子质量变小
B. 反应达到平衡后,保持容器温度和体积不变,充入HI气体,再次达到平衡,H2转化率减小,平衡常数K值减小
C. 若v正(H2)=2v逆(HI),反应达到平衡状态
D. 反应达到平衡后,保持容器体积不变,升温,反应体系的颜色加深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com