
【题目】有一支50mL酸式滴定管,其中盛有溶液,液面恰好在10mL刻度处,现把管内液体全部流下排出,用量筒接收,所得溶液的体积( )
A. 不能确定 B. 为40mL C. 为10mL D. 大于为40mL
科目:高中化学 来源: 题型:
【题目】下列物质的变化,不能通过一步化学反应完成的是
A. Cu→CuSO4 B. SiO2→H2SiO3 C. Cl2→HClO D. NO2→HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可以产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去,且洗气瓶中高锰酸钾溶液足量)。试回答:
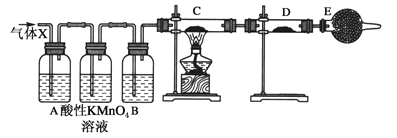
(1)上述反应中生成二氧化硫的化学方程式为:__________________。
(2)乙同学认为还可能产生氢气的理由是:_____________________。
(3)丙同学在安装好装置后,必不可少的一步操作是:________________。
(4)A中加入的试剂可能是____________,作用是_______________;B中加入的试剂可能是________,作用是_____________;E中加入的试剂可能是_____________,作用是________________。
(5)可以证明气体X中含有氢气的实验现象是:C中:______________,D中:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《化学与生活》
(1)国庆是传统的节日。在外地的人们会乘坐各种交通工具回家与亲人团圆。
① 航空旅行舒适快捷。制造飞机轮胎的主要材料是 (填字母)。
a.铝合金 b.橡胶 c.玻璃
② 铁路是主要的交通工具。建设铁路需要大量水泥。工业上生产水泥的主要原料是石灰石和 (填字母)。
a.黏土 b.纯碱 c.石英
③ 轮船也是重要的交通工具。为保护钢板不受腐蚀,在船尾钢板上镶嵌的金属块是 (填字母)。
a.铜块 b.锌块 c.锡块
(2)国庆节期间聚会要注意饮食健康,保证身体健康。
①平时要多喝水。水在人体中有重要的生理功能。下列物质在人体中可以水解的是 (填字母)
a.葡萄糖 b.氨基酸 c.油脂
②合理选择饮食。鸡、鸭、鱼、肉是常见食材,它们富含的营养物质是油脂和 ;富含淀粉的面点老少皆宜,淀粉的化学式是 ;蔬菜和水果富含维生素C,是人体所必须的。医用维生素C片常在药片外包裹一层“糖衣”,其作用除了改善口感外,更重要的作用是 。
③橙汁是家宴的常用饮品。某品牌橙汁中含有白砂糖、精制盐、柠檬黄和苯甲酸钠,这几种物质中属于着色剂的是 。
④饮食不当会引起胃痛。胃舒平[主要成分是Al(OH)3]可治疗胃酸过多,写出Al(OH)3与胃酸反应的离子方程式 。
(3)国庆期间,在娱乐、购物、旅游时要讲究文明、保护环境。
①蓝天白云是假日出行的最佳天气,“阅兵蓝”为2015年科技热词。较多排放下列气体不利于蓝天出现的是 (填字母)。
a.N2 b. NO2 c.CO2
②用过的聚乙烯塑料食品袋要投入贴有可回收物标志的垃圾箱中。聚乙烯的结构简式是 。
③私家车给假日旅游带来方便,但添堵、污染不可回避。汽车尾气中的CO和NO2在催化剂的作用下可转化为无害气体排出,其化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知强酸与强碱的稀溶液发生中和反应的热化学方程式为 H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,又知电解质的电离是吸热过程。向1 L 0.5 mol·L-1的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应。则其焓变ΔH1、ΔH2、ΔH3的关系是( )
A. ΔH1>ΔH2>ΔH3 B. ΔH1<ΔH3<ΔH2
C. ΔH1=ΔH3>ΔH2 D. ΔH1>ΔH3>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S水溶液中存在电离平衡H2S![]() H++HS-和HS-
H++HS-和HS-![]() H++S2-,若向H2S溶液中
H++S2-,若向H2S溶液中
A.加水,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH增大
C.滴加新制氯水,平衡向左移动,溶液pH减小
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废液中含有Fe3+、Cu2+、Ag+金属离子,某研究小组设计的处理方案如下(假如各步骤所加试剂都过量):
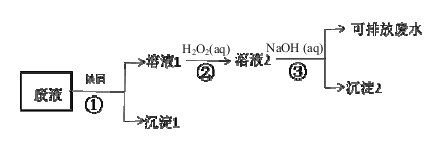
(1)沉淀1的主要成分是_________(用元素符号表示),沉淀2化学式为___ ___。
(2)步骤②发生反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100 mLNaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入2.0 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。
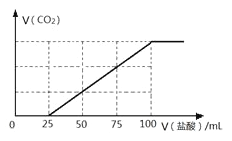
回答下列问题:
(1)原NaOH溶液的物质的量浓度为______ mol/L;
(2)题中通入CO2后所得溶液的溶质成分为______将所得溶质在低温低压条件下蒸干,所得固体物质(不带结晶水)的质量为_______ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率说法正确的是
A.化学反应速率是指一定时间内任何一种反应物浓度的减小或任何一种生成物浓度的增加
B.根据化学反应速率的大小可以知道化学反应进行的快慢
C.化学反应速率0.8 mol/(L·s)是指1 s时某物质的浓度为0.8 mol/L
D.对于任何化学反应来说,反应速率越大,反应现象就越明显
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com