
【题目】在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
(1)写出反应的化学方程式并标出电子转移的方向和数目______________。
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是____,_________。
【答案】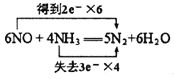 0.3molNO和0.7molNH3 0.2molNH3和0.8molNO
0.3molNO和0.7molNH3 0.2molNH3和0.8molNO
【解析】
反应的方程式为:6NO+4NH3=5N2+6H2O,根据化合价的变化判断电子转移的方向和数目;根据化学方程式以及经还原得到的N2比经氧化得到的N2多1.4g,利用讨论法计算原反应混合物中NO与NH3的物质的量。
(1)NO跟NH3可以发生反应生成N2和H2O ,根据电子守恒、原子守恒,可得反应的化学方程式:6NO+4NH3=5N2+6H2O。在该反应中,N元素的化合价由反应前NO中的+2价变为反应后N2中的0价,化合价降低2,获得2个电子,N元素的化合价由反应前NH3中的-3价变为反应后N2中的0价,化合价升高3,失去3个电子,根据化合价升降总数相等,等于元素化合价升降总数,可知NO的系数是3,NH3的系数是2,反应产生的N2的系数是5/2,H2O的系数是3,然后都扩大2倍,变为整数系数,可得该反应的电子转移表示式: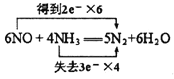 ;
;
(2)在反应方程式为6NO+4NH3=5N2+6H2O,该反应中氧化产物和还原产物都是氮气,根据方程式可知:若有6molNO发生反应,会消耗4molNH3,产生5molN2,还原产物比氧化产物多1mol,现在还原产物比氧化产物多1.4g,则还原产物比氧化产物多![]() =0.05mol,反应的NO的物质的量是0.3mol,反应的氨气的物质的量是0.2mol。由于二者的物质的量的和是1mol,所以过量的气体的物质的量是1mol-0.2mol-0.3mol=0.5mol。假设NO完全反应,则NO的物质的量=
=0.05mol,反应的NO的物质的量是0.3mol,反应的氨气的物质的量是0.2mol。由于二者的物质的量的和是1mol,所以过量的气体的物质的量是1mol-0.2mol-0.3mol=0.5mol。假设NO完全反应,则NO的物质的量=![]() ×6=0.3mol,氨气的物质的量是n(NH3)=1mol-0.3mol=0.7mol;假设氨气完全反应,则NH3的物质的量是0.2mol,则NO的物质的量=1mol-
×6=0.3mol,氨气的物质的量是n(NH3)=1mol-0.3mol=0.7mol;假设氨气完全反应,则NH3的物质的量是0.2mol,则NO的物质的量=1mol-![]() ×4=0.8mol,所以原反应混合物中NO与NH3的物质的量可能0.3molNO和0.7molNH3或0.2molNH3和0.8molNO。
×4=0.8mol,所以原反应混合物中NO与NH3的物质的量可能0.3molNO和0.7molNH3或0.2molNH3和0.8molNO。
故答案是:0.3molNO和0.7molNH3或0.2molNH3和0.8molNO。


科目:高中化学 来源: 题型:
【题目】MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。实验室模拟以MnO2为原料生产MnCO3的工艺流程如下:
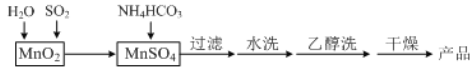
已知:MnCO3难溶于水和乙醇,受热易分解。
(1)实验室中过滤操作所用到的玻璃仪器有漏斗、烧杯、___。
(2)①检验水洗是否合格的方法是___。
(3)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为___;图中点D对应固体的成分为___(填化学式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室要配制480mL0.1mol·L-1Na2CO3溶液,回答下列问题。
(1)应用托盘天平称取Na2CO3·10H2O晶体___g。
(2)配制Na2CO3溶液时需用的主要玻璃仪器有烧杯、玻璃棒、___、___。
(3)若实验遇下列情况,溶液的浓度偏低的是___
A.加水时超过刻度线
B.忘记将洗涤液加入容量瓶
C.容量瓶内壁附有水珠而未进行干燥处理
D.定容后摇匀,液面低于刻度线
E.称量时砝码生锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将红热的固体单质甲放入显黄色的浓乙溶液中,剧烈反应,产生混合气体A,A在常温下不与空气作用,发生如下图所示的变化。

则:①写出下列物质的化学式:
丙__________,B____________,C__________, D____________。
②写出甲跟乙反应的化学方程式:__________________________。
③单质丙与溶液乙反应生成气体B的离子方程式:___________________。
(2)如图是各物质的反应关系图:已知A和E都是黄色粉末,F有刺激性气味且有漂白性。请据此回答下列问题:
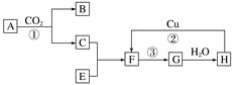
写出图中编号的化学方程式:
①_______________________;
②_______________________;
③______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究生铁的锈蚀,下列分析不正确的是
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组以菱铁矿(主要成分为FeCO3,含有SiO2、Al2O3等少量杂质)为原料制备氯化铁晶体(FeCl3·6H2O)的实验过程如下:

(1)酸溶及后续过程中均需保持算过量,其目的除了提高铁元素的浸出率之外,还有___________。
(2)操作Ⅰ名称是_______________。
(3)滴加H2O2溶液氧化时,发生主要反应的离子方程式为_________________。
(4)在氧化过程中,如何检验铁元素全部以Fe3+形式存在:_______________________。
(5)加入过量NaOH溶液的目的是__________________。
(6)请补充完整由过滤后得到的固体制备FeCl3·6H2O的实验方案:向过滤后所得固体______,用水洗涤固体2-3次,低温干燥,得到FeCl3·6H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于短周期的四种主族元素A、B、C、D,原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。E是我国使用最早合金中的主要成分。根据你的推断完成下列问题:
(1)B、C、E的元素符号为________,________,__________。
(2)写出由上述元素形成的具有漂白作用的四种物质的化学式______、______、______、______。
(3)由A、B两种元素形成的原子个数比为1∶1的化合物的电子式______。
(4)写出D的最高价氧化物对应水化物与E反应的化学方程式,并用双线桥标出电子转移的方向和数目___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。

①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
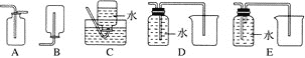
(4)以下收集NO气体的装置,合理的是________(填序号)。
(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁四种短周期元素的位置如图所示(其中乙、丙、丁的位置未标出)。
![]()
已知四种元素的原子序数之和为36,乙的原子序数与甲、丁原子序数之和相等。
(1)甲元素在周期表中的位置为______________。
(2)丙、丁可形成AB2型化合物,其化学式为________。
(3)丙是自然界中形成化合物种类最多的元素,则丙是________(填名称),其单质与甲元素的最高价氧化物对应水化物的浓溶液共热时反应的化学方程式是______________________。
(4)若甲、乙、丙、丁四种元素两两化合时,丁与其他三种元素得到的化合物种类最多,则丁是________(填元素符号),写出这些化合物中任意两种符合以下条件的化学式______________________
(①原子个数比为1∶2;②分子中价电子总数为偶数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com