
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. CCl4和SiCl4的熔点
B. 对羟基苯甲醛(![]() )和邻羟基苯甲醛(
)和邻羟基苯甲醛(![]() )的沸点
)的沸点
C. I2在水中的溶解度和I2在CCl4溶液中的溶解度
D. H2SO3和H2SO4的酸性
科目:高中化学 来源: 题型:
【题目】某物质只含 C、H、O 三种元素,其分子模型如下图所示,分子中共有 12 个原子(图中球与球之间的连线表示化学键),下列说法不正确的是:

A.该物质的分子式为:C4H6O2
B.该物质所含的官能团名称为:羟基
C.该物质能与 NaHCO3 溶液反应
D.CH3CH=CHCOOH 与该物质互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一个电化学装置的示意图。
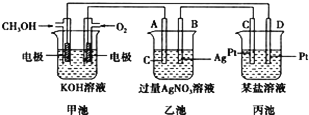
请回答下列问题:
(1)图中丙池是__(填“原电池”、“电解池”或“电镀池”)。
(2)B电极的名称是__(填“正极”、“负极”、“阴极”或“阳极”)。
(3)写出通人CH3OH的电极的电极反应式:___。
(4)乙池中反应的化学方程式为___。
(5)当乙池中B(Ag)极质量增加10.8g时,甲池中理论上消耗O2的体积为___L(标准状况),此时丙池中某电极析出2.8g某金属,则丙池中的某盐溶液可能是___(填字母)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子 PVA 可用于制滴眼露液,还可制成人工肾膜等医疗产品。由乙炔合成 PVA的过程如下:
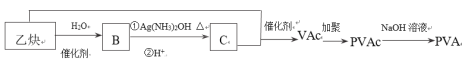
已知:VAc 的结构简式为 CH3COOCH=CH2。
(1)B 与银氨溶液反应的化学方程式是________________。
(2)乙炔与 C 反应的化学方程式是_____________。
(3)PVA 的结构简式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于化学反应的研究结论正确的是
A.已知常温常压下4Fe(s)+3O2(g)=2Fe2O3(s)是自发反应,则该反应是吸热反应
B.溶液中的离子反应的活化能很高
C.一定条件下2molPCl3和2molCl2发生反应PCl3(g)+Cl2(g)![]() PCl5(g) ΔH=-93kJmol-1,达平衡时放热139.5kJ,则PCl3的转化率为75%
PCl5(g) ΔH=-93kJmol-1,达平衡时放热139.5kJ,则PCl3的转化率为75%
D.用pH分别为2和3的醋酸中和等量的NaOH,消耗醋酸的体积分别为V1和V2,则V1>10V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1911年,科学家发现汞在4.2K以下时电阻突然趋近于零——即低温超导性。1986年,科学家又发现了Nb3Ge在23K下具有超导性。1987年2月,赵忠贤及合作者独立发现了在液氮温区(沸点77 K)的高温超导体,其晶胞如图所示,元素组成为Ba-Y-Cu-O(临界温度93 K),推动了国际高温超导研究。赵忠贤院士获得2016年度国家最高科学技术奖。

回答下列问题:
(1)铌Nb位于第五周期,Nb的外围电子排布式为4d45s1,Nb位于_______族。
(2)下列关于Ge元素叙述正确的是______(从下列选项中选择)。
A.Ge晶体属于准金属,且为原子晶体 B.Ge属于p区的过渡金属
C.Ge的第一电离能比As、Se均要小 D.Ge的电负性比C大
(3)Ge(CH3)2Cl2分子的中心原子Ge的杂化方式是______________。
(4)NH3也常作致冷剂,其键角_______(填“大于”或“小于”)109°28′,主要原因是___________________________________________________________________________。
(5)图示材料的理想化学式(无空位时)为___________________,若Y(钇)元素的化合价为+3,则Cu的平均化合价为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中溴含量约为65mg·L-1,从海水中提取溴的工艺流程如图:

(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是_____。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的______(填字母)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
________Br2+________![]() =________
=________![]() +_Br-+_CO2↑
+_Br-+_CO2↑
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:______。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是______(填字母)。
A.稀硫酸 B.四氯化碳 C.烧碱溶液 D.水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:

已知:①菱锰矿石主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素;
②常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11
③相关金属离子c(Mn+)=0.1mol/L形成氯氧化物沉淀时的pH如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
回答下列问题:
(1)“焙烧”时发生的主要化学反应方程式为______________________。
(2)分析下列图1、图2,氯化铵焙烧菱镁矿的最佳条件是:焙烧温度_________,氯化铵与菱镁矿粉的质量之比为_________。
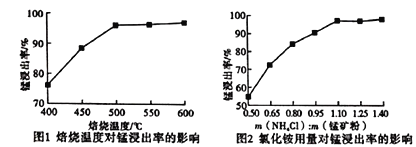
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式______;然后调节溶液pH使Fe3+、Al3+沉淀完全,此时溶液的pH范围为_________。再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5mol/L时,c(Mg2+)=______mol/L
(4)碳化结晶时,发生反应的离子方程式为____________________________。
(5)流程中能循环利用的固态物质是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示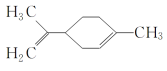 ,下列有关该有机物的说法正确的是( )
,下列有关该有机物的说法正确的是( )
A.该有机物的化学式为C10H14
B.它的一氯代物有6种
C.该有机物分子中所有的碳原子一定在同一平面上
D.一定条件下,它可以发生取代、加成、氧化和还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com