
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:

已知:①菱锰矿石主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素;
②常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11
③相关金属离子c(Mn+)=0.1mol/L形成氯氧化物沉淀时的pH如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
回答下列问题:
(1)“焙烧”时发生的主要化学反应方程式为______________________。
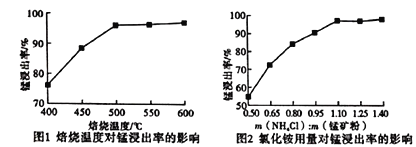
(2)分析下列图1、图2,氯化铵焙烧菱镁矿的最佳条件是:焙烧温度_________,氯化铵与菱镁矿粉的质量之比为_________。
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式______;然后调节溶液pH使Fe3+、Al3+沉淀完全,此时溶液的pH范围为_________。再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5mol/L时,c(Mg2+)=______mol/L
(4)碳化结晶时,发生反应的离子方程式为____________________________。
(5)流程中能循环利用的固态物质是____________。
【答案】MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O 500℃ 1.10 MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O 5.2≤pH<8.8 5×10-6 Mn2++2HCO3-
MnCl2+2NH3↑+CO2↑+H2O 500℃ 1.10 MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O 5.2≤pH<8.8 5×10-6 Mn2++2HCO3-![]() MnCO3↓+CO2↑+H2O NH4Cl
MnCO3↓+CO2↑+H2O NH4Cl
【解析】
根据流程:将菱镁矿粉(主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素)与氯化铵混合研磨后焙烧:MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O,浸出,浸出液含有Mn2+、Fe2+、Al3+、Ca2+、Mg2+,加入MnO2将Fe2+氧化为Fe3+:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,然后调节溶液pH范围5.2≤pH<8.8使Fe3+、A13+沉淀完全,再加入NH4F沉淀Ca2+、Mg2+,过滤除去Fe(OH)3、Al(OH)3、CaF2、MgF2,净化液的成分主要含有MnCl2,加入碳酸氢铵碳化结晶,发生反应:Mn2++2HCO3-
MnCl2+2NH3↑+CO2↑+H2O,浸出,浸出液含有Mn2+、Fe2+、Al3+、Ca2+、Mg2+,加入MnO2将Fe2+氧化为Fe3+:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,然后调节溶液pH范围5.2≤pH<8.8使Fe3+、A13+沉淀完全,再加入NH4F沉淀Ca2+、Mg2+,过滤除去Fe(OH)3、Al(OH)3、CaF2、MgF2,净化液的成分主要含有MnCl2,加入碳酸氢铵碳化结晶,发生反应:Mn2++2HCO3-![]() MnCO3↓+CO2↑+H2O,过滤,得到MnCO3产品和滤液NH4Cl,将滤液NH4Cl蒸发结晶得到NH4Cl晶体可循环使用,据此分析作答。
MnCO3↓+CO2↑+H2O,过滤,得到MnCO3产品和滤液NH4Cl,将滤液NH4Cl蒸发结晶得到NH4Cl晶体可循环使用,据此分析作答。
(1)根据流程,菱镁矿粉与氯化铵混合研磨后焙烧得到氨气、二氧化碳和Mn2+,主要化学反应方程式为:MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O;
MnCl2+2NH3↑+CO2↑+H2O;
(2)由图可知,锰的浸出率随着焙烧温度、氯化铵与菱镁矿粉的质量之比、焙烧时间增大而提高,到500℃、1.10、60min达到最高,再增大锰的浸出率变化不明显,故氯化铵焙烧菱镁矿的最佳条件是焙烧温度500℃,氯化铵与菱镁矿粉的质量之比为1.10;
(3)浸出液含有Mn2+、Fe2+、Al3+、Ca2+、Mg2+,加入MnO2将Fe2+氧化为Fe3+:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;然后调节溶液pH使Fe3+、A13+沉淀完全,同时不使Mn2+沉淀,根据表可知调节溶液pH范围5.2≤pH<8.8,再加入NH4F沉淀Ca2+、Mg2+,已知:CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11,当c(Ca2+)=1.0×10-5mo1L-1时,c2(F-)=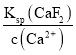 =1.46×10-5mol/L,c(Mg2+)=
=1.46×10-5mol/L,c(Mg2+)=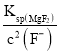 =5.0×10-6mol/L;
=5.0×10-6mol/L;
(4)净化液的成分主要含有MnCl2,碳化结晶时,发生反应的离子方程式为Mn2++2HCO3-![]() MnCO3↓+CO2↑+H2O;
MnCO3↓+CO2↑+H2O;
(5)根据分析和流程可知,可以循环使用的固体物质是NH4Cl。


科目:高中化学 来源: 题型:
【题目】有关下图的说法正确的是( )
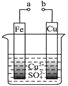
A.a和b连接构成原电池,溶液中SO42-移向Cu极
B.a和b连接构成原电池,Cu极上发生还原反应
C.a、b分别接直流电源正、负极,电子从Cu片流向b
D.a、b分别接直流电源正、负极,可以在Fe片上镀Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. CCl4和SiCl4的熔点
B. 对羟基苯甲醛(![]() )和邻羟基苯甲醛(
)和邻羟基苯甲醛(![]() )的沸点
)的沸点
C. I2在水中的溶解度和I2在CCl4溶液中的溶解度
D. H2SO3和H2SO4的酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸雨的形成是一种复杂的大气化学和光学化学过程,在清洁空气、污染空气中形成硫酸型酸雨的过程如下:

下列有关说法错误的是( )
A. 光照能引发酸雨的形成
B. 所涉及的变化均为氧化还原反应
C. 污染空气能加快酸雨的形成
D. 优化能源结构能有效遏制酸雨污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应,生成28gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应,生成28gN2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于离子共存或离子反应的说法正确的是( )
A.pH=2的溶液中可能大量存在Na+、![]() 、
、![]()
B.某无色溶液中可能大量存在H+、Cl-、![]()
C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D.稀硫酸与Ba(OH)2溶液的反应:H++![]() +Ba2++OH-=BaSO4↓+H2O
+Ba2++OH-=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
CH3OCH3(g)+H2O(g) ΔH=-25 kJ·mol-1。某温度下的平衡常数为400。此温度下,在1 L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如下表。下列说法中不正确的是( )
物质 | CH3OH | CH3OCH3 | H2O |
c/mol·L-1 | 0.08 | 1.6 | 1.6 |
A. 此时刻反应达到平衡状态
B. 容器内压强不变时,说明反应达平衡状态
C. 平衡时,再加入与起始等量的CH3OH,达新平衡后CH3OH转化率不变
D. 平衡时,反应混合物的总能量降低40 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向密闭容器中充入1.0 mol CO和2.0 mol H2O(g)发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)。当反应达平衡时,CO的体积分数为α。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达平衡时CO的体积分数小于α的是
CO2(g)+H2(g)。当反应达平衡时,CO的体积分数为α。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达平衡时CO的体积分数小于α的是
A.0.5 mol CO+2.0 mol H2O(g)+1.0 mol CO2+1.0 mol H2
B.1.0 mol CO+2.0 mol H2O(g)+0.5 mol He
C.1.0 mol CO+1.0 mol H2O(g)+1.0 mol CO2+1.0 mol H2
D.0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S2O3是一种弱酸,实验室欲用0.01 mol·L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3===2NaI+Na2S4O6,下列说法合理的是( )
A.该滴定可用甲基橙作指示剂
B.Na2S2O3是该反应的还原剂
C.该滴定可选用如图所示装置

D.该反应中每消耗2 mol Na2S2O3,电子转移数为4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com