
【题目】溴化钙具有易溶于水、易吸潮等性质。溴化钙可用作阻燃剂、制冷剂,实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
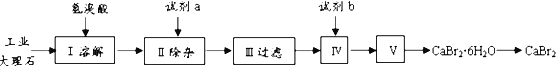
回答下列问题:
(1)已知步骤III的滤液中不含NH4+。步骤II加入的试剂a是___________,控制溶液的pH约为8.0的目的是___________、___________。
(2)试剂b是___________,步骤IV的目的是_______。
(3)步骤V所含的操作依次是________________、过滤。
(4)制得的溴化钙可以通过如下步骤测定其纯度:
称取4.00g无水溴化钙样品;溶解;滴入足量Na2CO3溶液,充分反应;过滤;烘干;冷却。若得到1.88g碳酸钙,则溴化钙的质量分数为_________。 若实验操作规范而测定结果偏低,其原因是_______________。
【答案】氢氧化钙 使铁离子、铝离子沉淀完全 防止氢氧化铝溶解 HBr 除去过量的氢氧化钙 蒸发浓缩,冷却结晶 94% CaBr2吸水
【解析】
(1)加入试剂a、控制溶液的pH约为8.0的目的是除去杂质Al3+、Fe3+,防止氢氧化铝溶解,因此a是碱,根据题意及不引入新的杂质可知是氢氧化钙;
(2)加试剂b的目的是除去过量的a,是氢溴酸;
(3)步骤Ⅴ的结果得到CaBr26H2O,因此其操作步骤为蒸发浓缩,冷却结晶、过滤;
(4)根据CaBr2~CaCO3可求CaBr2的质量,进而计算质量分数;溴化钙易吸水,因此造成测定结果偏低。
(1)加入试剂a,控制溶液的pH约为8.0的目的是除去杂质Al3+、Fe3+,防止氢氧化铝溶解, a是碱,根据题意及不引入新的杂质可知是氢氧化钙;
(2)加试剂b的目的是除去过量的氢氧化钙,且不引入新杂质,b应是氢溴酸;
(3)步骤Ⅴ的结果从溶液中得到CaBr26H2O,因此其操作步骤为蒸发浓缩,冷却结晶、过滤;
(4)CaBr2~CaCO3
200 100
3.76g 1.88g
CaBr2的质量为3.76g,质量分数为=![]() ×100%=94%;溴化钙易吸水,因此造成测定结果偏低。
×100%=94%;溴化钙易吸水,因此造成测定结果偏低。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】聚合物F的合成路线图如图:

已知:HCHO+RCH2CHO![]()
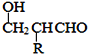
![]()
![]()
请据此回答:
(1)A中含氧官能团名称是________________,C的系统命名为_____________________ 。
(2)检验B中所含官能团所用的试剂有______________、_____________;E→F的反应类型是______________,B+D![]() E的反应类型是______________________。
E的反应类型是______________________。
(3)写出A→B的化学方程式__________________________________________________。
(4)写出C→D的化学方程式__________________________________________________。
(5)参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要原料制备![]() 的合成路线_______________________________________________________________
的合成路线_______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2010年4月,科学家成功合成了一种拥有117个质子的新元素。科学家用![]() Ca轰击
Ca轰击![]() Bk,生成了6个拥有117个质子的新原子,其中的5个原子有176个中子,1个原子有177个中子。下列有关说法正确的是( )
Bk,生成了6个拥有117个质子的新原子,其中的5个原子有176个中子,1个原子有177个中子。下列有关说法正确的是( )
A. 第117号元素是副族元素B. ![]() Bk的质量数为97
Bk的质量数为97
C. 第117号元素是非金属元素D. ![]() Ca2+的中子数比核外电子数多10
Ca2+的中子数比核外电子数多10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将BaO2放入密闭的真空容器中,反应2BaO2(s) ![]() 2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是( )
A. 平衡常数减小B. BaO量不变C. 氧气浓度不变D. 平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 3O2(g) == 2O3(g) ΔH>0,则可判定O2(g)比O3(g)稳定
B. 由1 mol H2形成2 mol H要放出热量
C. 500℃、30 MPa下,0.5 mol N2(g)和1.5 mol H2(g)反应生成NH3(g)放热Q kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-2Q kJ/mol
2NH3(g) ΔH=-2Q kJ/mol
D. 已知Ni(CO)4(g)=Ni(s)+4CO(g) ΔH=Q kJ/mol(Q>0),则Ni(s)+4CO(g)=Ni(CO)4(g) ΔH=-Q kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在:钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)工艺流程如下:
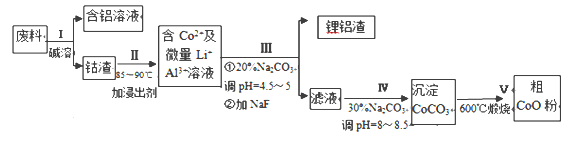
(1)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为_________________。
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为 (产物中只有一种酸根)_________。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从氧化还原和环境保护的角度分析不用盐酸浸出钴的主要原因____。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式_____ 。
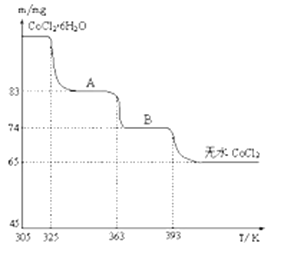
(4)如图是CoCl2.6H2O晶体受热分解时,剩余固体的质量随温度变化的曲线,B物质的化学式是______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18mol·L-1浓硫酸配制250mL0.9mol·L–1稀硫酸的步骤如下:
①计算所用浓硫酸的体积;②量取一定体积的浓硫酸;③稀释;④ ;⑤转移、洗涤;⑥定容、摇匀;⑦装瓶贴标签
完成下列问题:
(1)计算所需浓硫酸的体积为___。步骤④的内容为___。
(2)容量瓶使用前必须___,容量瓶上需标有以下五项中的___(填序号);
①温度②浓度③容量④压强⑤刻度线
(3)第③步实验的操作中用到的玻璃仪器有___。
(4)下列情况对所配制的稀硫酸浓度有何影响?(选填“偏高”、“偏低”、“无影响”)。
①容量瓶用蒸馏水洗涤后残留有少量的水,则___;
②定容时俯视刻度线,则___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒钛磁铁矿炼钢后剩余的尾渣中含有V2O3、MgO、Al2O3、Fe2O3、SiO2等,现从该钒渣中回收V2O3及少量单质铝的工艺流程如下:
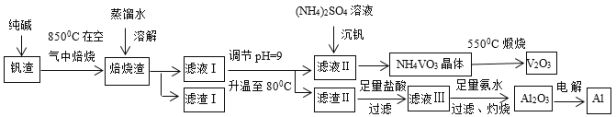
(1)滤液I的成分是NaVO3、NaAlO2和____(写化学式)。
(2)检验滤渣I中含有Fe2O3的方法是____。
(3)写出“焙烧”时生成NaVO3的化学方程式____。
(4)写出滤液Ⅲ与氨水反应生成沉淀的离子方程式____。
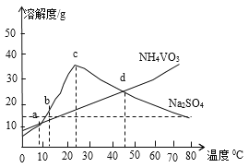
(5)NH4VO3和Na2SO4的混合液需要经过蒸发浓缩、趁热过滤、冷却结晶和过滤等操作得到NH4VO3晶体,结合图分析,为了得到较纯净的NH4VO3晶体和较高的晶体析出率,应选择最适宜的结晶温度为a、b、c、d四点中____点对应的温度。
(6)若经过(5)步骤后得到的是粗NH4VO3晶体,则精制NH4VO3晶体需要采用的操作为____。
(7)滤渣I中有一种成分可作红色油漆,该物质的另外一种用途是____(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.107 g Fe(OH)3胶体中胶体粒子的数目为NA
B.1 L 0.1 mol·L-1Na2CO3溶液中CO32-和HCO3-的离子数之和为0.1NA
C.常温常压下,3.6 g D2O与H218O中含有中子数2NA
D.30 g由14C2H2和C18O组成的混合气体中含有的质子数为14NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com