
【题目】一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在:钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)工艺流程如下:
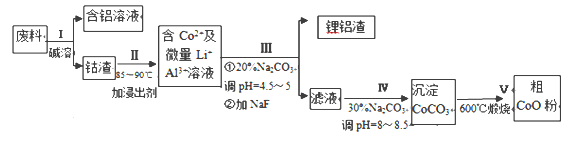
(1)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为_________________。
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为 (产物中只有一种酸根)_________。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从氧化还原和环境保护的角度分析不用盐酸浸出钴的主要原因____。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式_____ 。
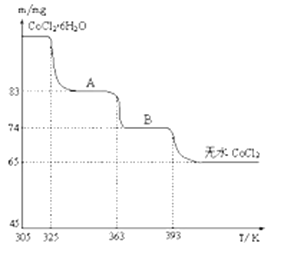
(4)如图是CoCl2.6H2O晶体受热分解时,剩余固体的质量随温度变化的曲线,B物质的化学式是______________ 。
【答案】2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑ 4Co3O4 + Na2S2O3+ 11H2SO4= 12CoSO4+ Na2SO4+11H2O Co2O3·CoO可氧化盐酸产生Cl2,污染环境 2Al3++3CO32-+3H2O = 2Al(OH)3↓+3CO2↑ CoCl2. H2O
【解析】
操作Ⅰ利用了铝能溶解在氢氧化钠溶液的性质,将铝从废料中分离出来,过滤后得到含Co2O3CoO的钴渣,再用酸溶解过滤后得到含Co3+及Al3+、Li+的滤液,通过调整溶液的pH得到Al(OH)3和LiF沉淀,再过滤得到含Co3+的滤液,再滴加Na2CO3溶液得到CoCO3沉淀,经过滤、洗涤沉淀,最后将CoCO3进行加热分解可得CoO粉末。
(1)铝和氢氧化钠溶液反应生成四羟基合铝酸钠和氢气,离子反应方程式为:2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑;
(2)Co3O4和Na2S2O3在酸性条件下发生氧化还原反应生成CoSO4、Na2SO4和H2O,反应方程式为:4Co3O4 + Na2S2O3+ 11H2SO4= 12CoSO4+ Na2SO4+11H2O,盐酸具有还原性,能被Co2O3CoO氧化生成有毒的氯气而污染环境,不能用盐酸;
(3)铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O = 2Al(OH)3↓+3CO2↑;
(4)根据图象可知,加热时Co的物质的量不变,由A到B减少9mg,由B到无水CoCl2减少9g,65mg的物质的量为0.5![]() 10-3mol,9mg水的物质的量为0.5
10-3mol,9mg水的物质的量为0.5![]() 10-3mol,则B的化学式为CoCl2. H2O。
10-3mol,则B的化学式为CoCl2. H2O。


科目:高中化学 来源: 题型:
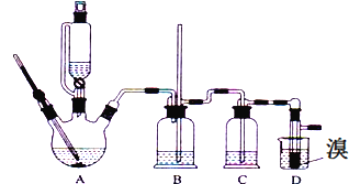
【题目】实验室用少量的溴和足量的乙醇、浓硫酸制备1,2﹣二溴乙烷的装置如下图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。有关数据列表如下:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)用少量的溴和足量的乙醇、浓硫酸制备1,2﹣二溴乙烷的需分两步进行,第二步反应的化学方程式为_______________
(2)在此实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_______(填正确选项前的字母)。
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入_______,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母)。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)将1,2﹣二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在________层(填“上”、“下”)。
(5)若产物中有少量未反应的Br2,最好用__________洗涤除去(填选项前字母)。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用__________的方法除去。
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有__________(填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________。
(3)检验沉淀中![]() 是否洗涤干净的操作是_______________________________________。
是否洗涤干净的操作是_______________________________________。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为________________。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙具有易溶于水、易吸潮等性质。溴化钙可用作阻燃剂、制冷剂,实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
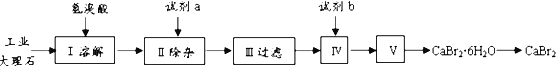
回答下列问题:
(1)已知步骤III的滤液中不含NH4+。步骤II加入的试剂a是___________,控制溶液的pH约为8.0的目的是___________、___________。
(2)试剂b是___________,步骤IV的目的是_______。
(3)步骤V所含的操作依次是________________、过滤。
(4)制得的溴化钙可以通过如下步骤测定其纯度:
称取4.00g无水溴化钙样品;溶解;滴入足量Na2CO3溶液,充分反应;过滤;烘干;冷却。若得到1.88g碳酸钙,则溴化钙的质量分数为_________。 若实验操作规范而测定结果偏低,其原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学常见的混合物分离或提纯的基本装置。
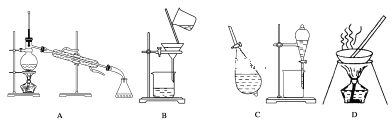
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)除去Fe(OH)3胶体中悬浮的Fe(OH)3沉淀___;
(2)从碘水中提取碘___;
(3)用自来水制取蒸馏水___;
(4)除去粗盐中的泥沙___;
(5)与海水晒盐原理相符的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在450℃并有催化剂存在下,在容积恒定的密闭容器内进行下列反应:2SO2 (g)+O2(g)![]() 2SO3(g) △H=-190kJmol-1
2SO3(g) △H=-190kJmol-1
(1)该反应500℃时的平衡常数____450℃时的平衡常数(填“>”、“<”或“=”)。
(2)450℃时,在2L密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是____。
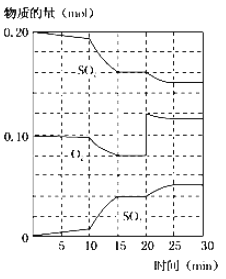
(3)据上图判断,反应进行至20min时,曲线发生变化的原因是___(用文字表达),10min到15min的曲线变化的原因可能是___(填字母)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3物质的量
(4)欲提高SO2的转化率,下列措施可行的是___。(填字母)
a.向装置中充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
II.已知HCl+O2![]() Cl2+H2O(未配平)中2mol HCl被氧化,放出57.8kJ的热量,且部分化学键断裂示意图如下:
Cl2+H2O(未配平)中2mol HCl被氧化,放出57.8kJ的热量,且部分化学键断裂示意图如下:
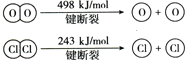
①写出该反应的热化学方程式是_____。
②断开1 mol H—O键与断开 1 mol H—Cl键所需能量相差约为___kJ,H2O中H—O键比HCl中H—Cl键_____(填“强”或“弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是
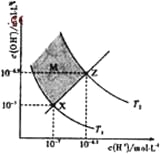
A. 两条曲线间任意点均有c(H+)×c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com