
【题目】聚合物F的合成路线图如图:

已知:HCHO+RCH2CHO![]()
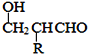
![]()
![]()
请据此回答:
(1)A中含氧官能团名称是________________,C的系统命名为_____________________ 。
(2)检验B中所含官能团所用的试剂有______________、_____________;E→F的反应类型是______________,B+D![]() E的反应类型是______________________。
E的反应类型是______________________。
(3)写出A→B的化学方程式__________________________________________________。
(4)写出C→D的化学方程式__________________________________________________。
(5)参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要原料制备![]() 的合成路线_______________________________________________________________
的合成路线_______________________________________________________________
【答案】醛基 1,2-二溴丙烷 NaHCO3溶液 溴水 加聚反应 取代反应 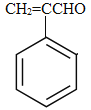 +2Cu(OH)2
+2Cu(OH)2![]() Cu2O↓+
Cu2O↓+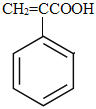 +2H2O CH3CHBrCH2Br+2NaOH
+2H2O CH3CHBrCH2Br+2NaOH![]() CH3CH(OH)CH2OH+2NaBr
CH3CH(OH)CH2OH+2NaBr 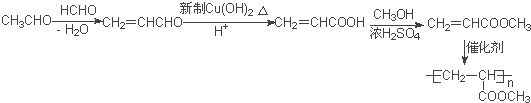
【解析】
苯乙醛与甲醛发生信息中先加成再消去生成A为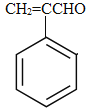 ,A与新制氢氧化铜悬浊液发生氧化反应,然后酸化得到B为
,A与新制氢氧化铜悬浊液发生氧化反应,然后酸化得到B为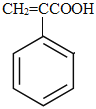 ,由F的结构简式可知E为
,由F的结构简式可知E为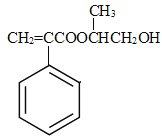 ,则D为
,则D为![]() ,故C3H6为CH3CH=CH2,丙烯与溴发生加成反应生成C为CH3CHBrCH2Br,C在氢氧化钠水溶液、加热条件下水解得到D;
,故C3H6为CH3CH=CH2,丙烯与溴发生加成反应生成C为CH3CHBrCH2Br,C在氢氧化钠水溶液、加热条件下水解得到D;
(5)甲醛与乙醛反应CH2=CHCHO,然后用新制氢氧化铜将醛基氧化为羧基,再与甲醇发生酯化反应生成CH2=CHCOOCH3,最后发生加聚反应可得![]() 。
。
(1)A为 ,A中含氧官能团名称是:醛基。C为CH3CHBrCH2Br,C的系统命名为:1,2-二溴丙烷;
,A中含氧官能团名称是:醛基。C为CH3CHBrCH2Br,C的系统命名为:1,2-二溴丙烷;
(2)B为 ,B中含有的含氧官能团为羧基,可用碳酸氢钠(或碳酸钠)溶液检验羧基,B中的碳碳双键用溴水检验;E→F生成高聚物,没有小分子物质生成,反应类型为加聚反应;B+D→E是羧基与羟基之间发生的酯化反应,属于取代反应;
,B中含有的含氧官能团为羧基,可用碳酸氢钠(或碳酸钠)溶液检验羧基,B中的碳碳双键用溴水检验;E→F生成高聚物,没有小分子物质生成,反应类型为加聚反应;B+D→E是羧基与羟基之间发生的酯化反应,属于取代反应;
(3)A→B的化学方程式为: +2Cu(OH)2
+2Cu(OH)2![]() Cu2O↓+
Cu2O↓+ +2H2O;
+2H2O;
(4)C→D的化学方程式为:CH3CHBrCH2Br+2NaOH![]() CH3CH(OH)CH2OH+2NaBr;
CH3CH(OH)CH2OH+2NaBr;
(5)甲醛与乙醛反应CH2=CHCHO,然后用新制氢氧化铜将醛基氧化为羧基,再与甲醇发生酯化反应生成CH2=CHCOOCH3,最后发生加聚反应可得![]() ,合成路线为:
,合成路线为: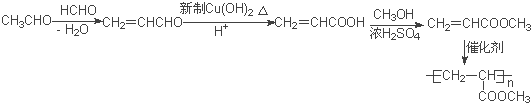 。
。


 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源: 题型:
【题目】从柑橘中炼制出有机物 ,下列有关该有机物的推测正确的是()
,下列有关该有机物的推测正确的是()
A. 分子式为C10H14B. 常温下为液态,难溶于水
C. 属于芳香烃D. 1 mol该物质与1 mol HCl加成所得产物有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表达下列反应的离子方程式为
A.用醋酸除去水垢:2H++CaCO3![]() Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
B.硫化亚铁与浓硫酸混合加热:2H++FeS![]() H2S↑+Fe2+
H2S↑+Fe2+
C.向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3CO32-![]() Al2(CO3)3↓
Al2(CO3)3↓
D.电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰水杨酸是一种常见的解热镇痛药,结构简式如图所示。下列有关叙述正确的是

A.乙酰水杨酸的分子式为C9H10O4
B.乙酰水杨酸的含氧官能团有三种
C.能与NaHCO3溶液反应的官能团有一种
D.烃基(C4H9)取代乙酰水杨酸苯环上的氢原子,最多能形成4种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用。回答下列问题:
I.实验室合成ClO2常用盐酸或双氧水还原氯酸钠(NaClO3)。
(1)盐酸和NaClO3反应时有ClO2和Cl2生成,书写反应的离子方程式并标出电子转移的方向和数目______________________________________,当反应中转移0.2mol电子时,参加反应的还原剂的物质的量为________________________________。
(2)使用双氧水作还原剂的优点是_________________________________________。
II.当pH≤2.0时,NaClO2能被I 完全还原成Cl;(离子反应方程式为ClO2+4H++4I→2I2+Cl+2H2O)。回答下列问题:
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6(2Na2S2O3+I2→2NaI+Na2S4O6)。欲测定成品中NaClO2的含量,现进行如下操作:
步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节pH≤2.0 |
步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定发生反应 |
(1)步骤Ⅱ加入指示剂的名称是_______________。滴定终点时溶液的颜色变化为_________。
(2)若上述滴定操作中平均消耗VmL Na2S2O3标准溶液,则成品中NaClO2的质量分数为__________(用含W、c、V的代数式表示)。
(3)ClO2和Cl2均能将电镀废水中的CN 氧化为无毒的物质,自身被还原为Cl,处理含相同量CN的电镀废水,所需Cl2的物质的量是ClO2的___倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
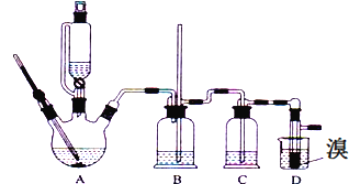
【题目】实验室用少量的溴和足量的乙醇、浓硫酸制备1,2﹣二溴乙烷的装置如下图所示,其中可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。有关数据列表如下:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)用少量的溴和足量的乙醇、浓硫酸制备1,2﹣二溴乙烷的需分两步进行,第二步反应的化学方程式为_______________
(2)在此实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_______(填正确选项前的字母)。
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(3)在装置C中应加入_______,其目的是吸收反应中可能生成的酸性气体(填正确选项前的字母)。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)将1,2﹣二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在________层(填“上”、“下”)。
(5)若产物中有少量未反应的Br2,最好用__________洗涤除去(填选项前字母)。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用__________的方法除去。
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
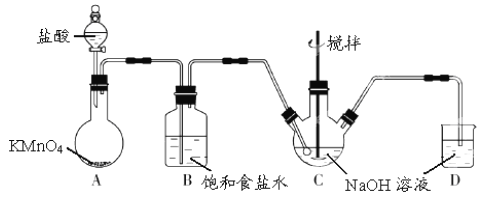
【题目】I.KMnO4 是一种氧化剂,实验室常用 KMnO4和浓盐酸反应制备 Cl2。下图是制备 NaClO溶液的装置图。
完成下列填空:
(1)KMnO4 稀溶液是一种常见消毒剂,其消毒机理与以下物质相似的是______(选填编号)。
a.75%酒精 b.双氧水 c.NaClO 溶液 d.硫磺皂
(2)B装置中饱和食盐水的作用是___________,D装置中NaOH的作用是______________。
(3)实验操作过程中可调节__________以控制A 装置中产生 Cl2 的气流,C装置需控制反应温度在 0~5℃,实验中可将C 装置放入________________中。
II.测定 KMnO4纯度可用标准 Na2S2O3(式量—158)溶液进行滴定,反应离子方程式为:8MnO4-+5S2O32-+14H+→10SO42-+8Mn2++7H2O。
(4)配制250 mL 0.1000 mol/L标准 Na2S2O3溶液,需准确称取Na2S2O3固体的质量为____g。
(5)取某 KMnO4(式量-158) 产品 0.600g,酸化后用 0.1000 mol/L 标准 Na2S2O3溶液进行滴定,滴定至终点消耗 Na2S2O3溶液 20.00 mL,则该 KMnO4 产品的纯度是_________(保留三位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溶液中加入新物质时, 其导电性(I)符合下图变化趋势的实验操作是
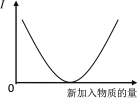
A. 乙酸溶液中通入氨气至过量
B. 石灰水中通入CO2至过量
C. 亚硫酸中通入氯气至过量
D. 氨水中通入氯化氢气体
查看答案和解析>>
科目:高中化学 来源: 题型:
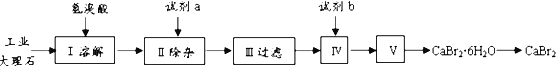
【题目】溴化钙具有易溶于水、易吸潮等性质。溴化钙可用作阻燃剂、制冷剂,实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
回答下列问题:
(1)已知步骤III的滤液中不含NH4+。步骤II加入的试剂a是___________,控制溶液的pH约为8.0的目的是___________、___________。
(2)试剂b是___________,步骤IV的目的是_______。
(3)步骤V所含的操作依次是________________、过滤。
(4)制得的溴化钙可以通过如下步骤测定其纯度:
称取4.00g无水溴化钙样品;溶解;滴入足量Na2CO3溶液,充分反应;过滤;烘干;冷却。若得到1.88g碳酸钙,则溴化钙的质量分数为_________。 若实验操作规范而测定结果偏低,其原因是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com