
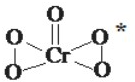
 (1)氧元素与多种元素具有亲和力,所形成化合物的种类很多.
(1)氧元素与多种元素具有亲和力,所形成化合物的种类很多.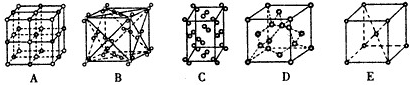
| 4-1+3 |
| 2 |
| 4-1+3 |
| 2 |


科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | Ⅷ |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.| 元 素 | Mn | Fe | |
| 电离能 /kJ?mol-1 |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
《有机化学基础》模块试题
1.有机黏合剂的黏合过程是液态的小分子黏合剂经化学反应转化为大分子或高分子而固化。
(1)“502胶”是一种快干胶,其主要成分为α氰基丙烯酸乙酯( ),请写出“502胶”发生黏合作用的化学方程式:_____________________________;反应类型是_____________。
),请写出“502胶”发生黏合作用的化学方程式:_____________________________;反应类型是_____________。
(2)厌氧胶( )也是一种黏合剂,工业上用丙烯酸和某物质在一定条件下反应可制得这种黏合剂,该物质的名称是_____________;请写出这一制取过程的化学方程式_________________。
)也是一种黏合剂,工业上用丙烯酸和某物质在一定条件下反应可制得这种黏合剂,该物质的名称是_____________;请写出这一制取过程的化学方程式_________________。
(3)白乳胶是常用的黏合剂,其主要成分为醋酸乙烯酯(CH3COOCH=CH2),它有多种同分异构体,如 、
、 、
、 。已知含有
。已知含有![]() 结构的物质不能稳定存在。请另外写出3种含—CH=CH—结构的链状同分异构体的结构简式:______________、______________、______________。
结构的物质不能稳定存在。请另外写出3种含—CH=CH—结构的链状同分异构体的结构简式:______________、______________、______________。
(4)已知醇和醛可以发生反应:2CH3OH+HCHO![]() CH3OCH2OCH3+H2O,聚乙烯醇可用做普通胶水,它的羟基可全部与丁醛(CH3CH2CH2CHO)缩合脱水,得到含六原子环的强力黏合剂聚乙烯缩丁醛。请写出制取聚乙烯缩丁醛的化学方程式:________________。
CH3OCH2OCH3+H2O,聚乙烯醇可用做普通胶水,它的羟基可全部与丁醛(CH3CH2CH2CHO)缩合脱水,得到含六原子环的强力黏合剂聚乙烯缩丁醛。请写出制取聚乙烯缩丁醛的化学方程式:________________。
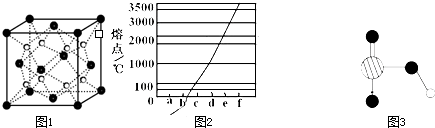
《物质结构与性质》模块试题2.如下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。

(1)请写出上图中d单质对应元素原子基态时的电子排布式_____________。
(2)单质a、f、b对应的元素以原子个数比1∶1∶1形成的分子中含_____________个σ键,_____________个π键。
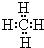
(3)a与b的元素形成的10电子中性分子X的空间构型为_____________;将X溶于水后的溶液滴入到含d元素高价离子的溶液中至过量,生成的含d元素离子的化学式为________
_______,其中X与d的高价离子之间以_____________键结合。
(4)上述六种元素中的一种元素形成的含氧酸的结构为:![]() ,该含氧酸的分子式为_____________,请简要说明该物质易溶于水的原因__________________________。
,该含氧酸的分子式为_____________,请简要说明该物质易溶于水的原因__________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省荆门市高三元月调考理综化学试卷(解析版) 题型:填空题
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。
(1)下列叙述正确的是?????? 。(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个 键和1个大
键和1个大 键,C6H6是非极性分子
键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
元??? 素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 |
Mn元素价电子排布式为?????????? ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是????????????????????????? 。
(3)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于 区。
(4)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为???????????? 。

(5)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为??????????????????? 。
②与CNO-互为等电子体微粒的化学式为?????????? (写出一种即可)。
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式?????? 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com