
【题目】下列说法正确的是
A.FeCl2溶液中滴加KSCN溶液,溶液不呈血红色
B.K2CO3溶液在火焰上灼烧时,火焰呈蓝色
C.干燥的氯气能使干燥有色布条褪色
D.乙醇可萃取碘水中的碘单质
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】观察下列几个装置示意图,有关叙述正确的是( )

A. 装置①工业上可用于生产金属钠,电解过程中石墨电极产生金属。
B. 装置②中阳极产生的气体可以使湿润的淀粉碘化钾试纸变蓝。
C. 装置③中的离子交换膜允许阳离子、阴离子和小分子水通过。
D. 装置④的待镀铁制品应与电源正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配平(1)(2);用双线桥法表示(3)(4)氧化还原反应的电子转移。
(1)(_____)KI+(_____)KIO3+(_____)H2SO4—(_____)I2+(_____)K2SO4+(_____)H2O
(2)(_____)Cu2S + (_____)HNO3 — (_____) Cu(NO3)2 + (_____)H2SO4 + (_____)NO2↑+(______)H2O
(3)MnO2+4HCl(浓)![]() MnCl2+C12↑+2H2O______
MnCl2+C12↑+2H2O______
(4)3S+6KOH=K2SO3+2K2S+3H2O_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备硝酸过程的一个重要反应为:4NH3+5O2===4NO+6H2O。下列有关该反应的说法正确的是
A.O2是还原剂B.NH3在反应中得到电子
C.氮元素被氧化D.O2发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,有①6.72LCH4,②3.01×1023个HCl,③13.6gH2S ,④0.2molNH3,则下列四种气体的关系表示正确的是()
A. 体积:④<①<②<③ B. 密度:①<③<④<②
C. 质量:④<①<③<② D. 氢原子数:②<③<④<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)是有重要用途的一元弱酸。请回答下列问题:
(1)单质硼溶于热的浓硝酸可以生成硼酸,该反应的化学方程式为___________。
(2)利用铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)制硼酸,已知天然的Fe3O4不溶于酸。生产硼酸的工艺流程如下:

①“浸渣”主要成分的化学式为_____________。
②“净化除杂”:滤液保持一定温度,需先加H2O2溶液,然后再调节溶液的pH=5.6。温度不宜过高的原因是___________。调节溶液的pH=5.6的主要目的是___________。
[已知:Ksp[Fe(OH)3]=2.6×10-39], Ksp[Al(OH)3]=1.3×10-33,
[已知:Ksp[Fe(OH)2]=4.7×10-6], Ksp[Mg(OH)2]=5.6×10-12,

(3)硼酸也可以通过电解方法制备。工作原理如图所示。
①写出阳极的电极反应式___________________。
②a膜或b膜为阳离子交换膜的是________;阴极室溶液的浓度________(填“变大”、“不变”、“变小”)。
(4)写出一定条件下硼酸与氢氧化钠溶液反应的化学方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂排出的废液主要含有硝酸锌和硝酸银,为了从中回收金属银和硝酸锌,某中学化学课外活动小组设计了以下的实验步骤:

(1)X是____________,Y是____________ (写化学式,下同)。
(2)固体A、滤液B、C的主要成分:A______________,B______________,C______________。
(3)Z处进行的操作是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1) NaClO2的化学名称为_______。
(2)在鼓泡反应器中通入含有含有SO2和NOx的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表》
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________。增加压强,NO的转化率______(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______ (填“提高”“不变”或“降低”)。
③由实验结果可知,脱硫反应速率______脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压px如图所示。
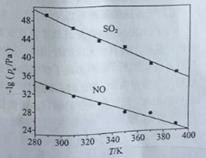
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的有点是_______。
②已知下列反应:
SO2(g)+2OH(aq) ===SO32(aq)+H2O(l) ΔH1
ClO(aq)+SO32(aq) ===SO42(aq)+Cl(aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO(aq) +2OH(aq) ="==" CaSO4(s) +H2O(l) +Cl(aq)的ΔH=______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com