
| A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 |
| B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同 |
| C.已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-a kJ·mol-1,②2H2(g)+O2(g)=2H2O(l) ΔH=-b kJ·mol-1,则a>b |
| D.已知:①C(s,石墨)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1,②C(s,金刚石)+O2(g)=CO2(g) ΔH=-395.0 kJ·mol-1,则C(s,石墨)=C(s,金刚石) ΔH=+1.5 kJ·mol-1 |
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.A的能量一定高于C |
| B.B的能量一定高于D |
| C.A和B的总能量一定高于C和D的总能量 |
| D.该反应为放热反应,故不必加热就一定能发生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.利用热效应大小可以判断某些物质的稳定性强弱 |
| B.利用密度数据可判断液体混合物是否可以通过蒸馏分离 |
| C.利用原子(或离子)半径数据可推断某些原子(或离子)的氧化性和还原性的强弱 |
| D.利用溶解度数据可推测将一些物质混合物分离开来的可能性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+H2(g)。
CO(g)+H2(g)。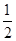 O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1
O2(g)=H2O(g) ΔH2=-242.0 kJ·mol-1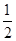 O2(g)=CO2(g) ΔH3=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH3=-283.0 kJ·mol-1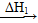 CO2(g)+H2O(g)
CO2(g)+H2O(g)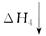

 CO(g)+H2O(g)+
CO(g)+H2O(g)+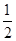 O2(g)
O2(g)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解水生成氢气和氧气时,电能转化为化学能 |
| B.绿色植物进行光合作用时,太阳能转化为化学能 |
| C.煤燃烧时,化学能主要转化为热能 |
| D.白炽灯工作时,电能全部转化为光能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学平衡发生移动,平衡常数不一定发生变化 |
| B.升高温度会增大化学反应速率,其原因是增大了活化分子的百分数 |
C.某化学反应的能量变化如图所示,则该反应的ΔH>0,ΔS>0 |
D.H3PO4的电离常数:  |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.55.2 kJ | B.391 kJ | C.336 kJ | D.1.38 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com