
【题目】如图是元素周期表的一部分:
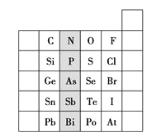
(1)阴影部分元素的外围电子排布式的通式为______。
(2)氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质可能有________。
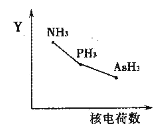
A.稳定性 B.沸点 C.R—H键能 D.分子间作用力
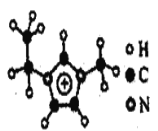
(3)如图EMIM+离子中,碳原子的杂化轨道类型为______。分子中的大π键可用符号πnm表示,其中n代表参与形成大π键的原子数,m代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),则EMM+离子中的大π键应表示为______。
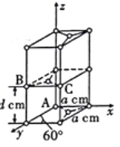
(4)晶胞有两个基本要素:石墨一种晶胞结构和部分晶胞参数如图。原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为A(0,0,0)、B(0,1,1/2),则C原子的坐标参数为___________。
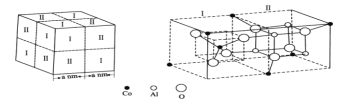
(5)钴蓝晶体结构如下图,该立方晶胞由4个I型和4个Ⅱ型小立方体构成,其化学式为___,晶体中Al3+占据O2-形成的__(填“四面体空隙”或“八面体空隙”)。NA为阿伏加德罗常数的值,钴蓝晶体的密度为____g·cm-3(列计算式)。
【答案】ns2np3 AC sp2、sp3 ![]()
![]() CoAl2O4 八面体空隙
CoAl2O4 八面体空隙 ![]()
【解析】
(1)阴影部分元素为氮族元素;
(2)同一主族元素的气态氢化物,非金属性越强的越稳定,其分子内的共价键的键能越大,据此分析作答;
(3)根据图示可知,环外三个烷基碳原子为sp3杂化,环内三个碳原子为sp2杂化;形成大π键的电子数=(4-3)×3+(5-3)×2-1=6;
(4)根据结构图的几何关系分析;
(5)根据晶胞的结构分析计算晶胞中原子数目,结合密度公式求解。
(1)阴影部分元素位于第VA族,其外围电子排布式的通式为:ns2np3;
(2)A.元素的非金属性越强,其氢化物越稳定,非金属性N>P>As,所以氢化物的稳定性随着原子序数增大而减弱,A项正确;
B.氢化物的熔沸点与其相对分子质量成正比,但含有氢键的熔沸点最高,氨气分子间存在氢键,因此沸点最高,所以沸点高低顺序是NH3、AsH3、PH3,B项错误;
C.原子半径越小,R-H键能越大,原子半径N<P<As,所以键能由大到小的顺序为NH3、PH3、AsH3,C项正确;
D. NH3、PH3、AsH3的相对分子质量逐渐增大,分子间作用力逐渐增大,与图示曲线不相符,D项错误;
故答案选AC;
(3)根据图示可知,环外三个碳原子都是形成4个σ键,为sp3杂化,环内三个碳原子都是形成3个σ键,1个大π键,为sp2杂化;形成大π键的电子数=(4-3)×3+(5-3)×2-1=6,则大π键可表示![]() ;答案:sp3 sp2;
;答案:sp3 sp2;![]() ;
;
(4)由B点坐标可得,a=1,d=1/2,所以C点坐标为![]() ;
;
(5)Ⅰ、Ⅱ各一个正方体为1个晶胞,该晶胞中Co原子个数=(4×1/8+2×1/4+1)×4=8个,I型和II型合起来的长方体中含有4个Al和8个O,晶胞内有4个I型和II型合起来的长方体,因而晶胞内总计有16个Al和32个O,Co、Al、O个数比为8:16:32=1:2:4,化学式为CoAl2O4;距离O2-最近的Al3+有6个,结合晶胞分析可知,6个Al3+组成八面体,因而晶体中Al3+占据O2—形成八面体空隙;每个晶胞内相当于拥有8个CoAl2O4,因而晶胞微粒质量m=![]() g,晶胞体积V=(2a×10-7)3cm3,密度等于
g,晶胞体积V=(2a×10-7)3cm3,密度等于![]() =
=![]() g/cm3=
g/cm3=![]() ,故答案为:CoAl2O4;八面体空隙;
,故答案为:CoAl2O4;八面体空隙;![]() 。
。


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】根据如图填空:

(1)反应物是______________,生成物是______________。
(2)在2 min内用A、B、C表示的化学反应速率分别为____________、____________、____________。
(3)该反应的化学方程式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
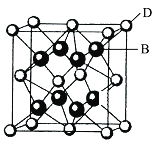
【题目】已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1~18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物,其晶胞结构如图。
请回答:
(1)A元素的名称是______。
(2)B的元素符号是__________,C的元素符号是______。
(3)E属元素周期表中第________周期第______族的元素,其元素名称是______,它的+2价离子的电子排布式为________。
(4)从图中可以看出,D跟B形成的离子化合物的化学式为______;该离子化合物晶体的密度为a g·cm-3,则晶胞的体积是______(只要求列出算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列有关叙述正确的是
A.32.5 g FeCl3水解所得的Fe(OH)3胶体粒子数为0.2NA
B.1 molCH4与足量Cl2在光照下反应生成的CH3Cl为NA
C.标准状况下,22.4 L苯含有NA个C6H6分子
D.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数为4 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NaCN溶液中存在水解平衡:CN-+H2O![]() HCN+OH-,水解常数
HCN+OH-,水解常数![]() [co(NaCN)是NaCN溶液的起始浓度]。25℃向1mol/L的NaCN溶液中不断加水稀释,NaCN溶液浓度的对数值lgc0与2pOH[p0H=-lgc(0H-)]的关系下图所示,下列说法错误的是
[co(NaCN)是NaCN溶液的起始浓度]。25℃向1mol/L的NaCN溶液中不断加水稀释,NaCN溶液浓度的对数值lgc0与2pOH[p0H=-lgc(0H-)]的关系下图所示,下列说法错误的是

A. 25℃时,Kn(CN-)的值为10-4.7
B. 升高温度,可使曲线上a点变到b点
C. 25℃,向a点对应的溶液中加入固体NaCN,CN-的水解程度减小
D. c点对应溶液中的c(OH-)大于a点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.A~D是四种烃分子的球棍模型(如图)

(1)与A互为同系物的是___________(填序号)。
(2)能使酸性高锰酸钾溶液褪色的物质是_____________(填序号)。
(3)D和液溴反应的化学方程式是_____________。
Ⅱ. 某些有机物的转化如下图所示。 已知A的产量可以用来衡量一个国家的石油化工水平,D是食醋的有效成分。

请回答下列问题:
(4)A中官能团的名称是______________。
(5)B的结构简式为_________________。
(6)反应③的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.10mol·L-1盐酸滴入20.00 mL 0.10mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列说法正确的是

A. M点所示溶液中c(NH4+)+c(NH3·H2O)=c(Cl-)
B. N点所示溶液中c(NH4+)>c(Cl-)
C. Q点消耗盐酸的体积等于氨水的体积
D. M点和N点所示溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4既是一种重要的能源,也是一种重要的化工原料。
(1)甲烷的电子式为__。
(2)甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是__。
(3)以CH4为燃料可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示,则通入a气体的电极名称为__,通入b气体的电极反应式__。(质子交换膜只允许H+通过)

(4)在一定温度和催化剂作用下,CH4与CO2可直接转化成乙酸,这是实现“减排”的一种研究方向。
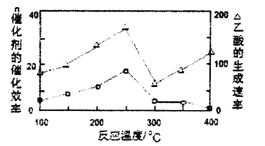
①在不同温度下,催化剂的催化效率与乙酸的生成速率如图所示,则该反应的最佳温度应控制在__左右。
②该反应催化剂的有效成分为偏铝酸亚铜(CuAlO2,难溶物)。将CuAlO2溶解在稀硝酸中生成两种盐并放出NO气体,其离子方程式为__。
(5)CH4还原法是处理NOx气体的一种方法。已知一定条件下CH4与NOx反应转化为N2和CO2,若标准状况下8.96LCH4可处理22.4LNOx,则x值为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2010年诺贝尔物理学奖用于表彰首次剥离出单层石墨的科学家。单层石墨称为石墨烯,这种“只有一层碳原子厚的碳薄片”的石墨烯,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,应用前景十分广阔。其结构示意图如图所示,

下列关于石墨烯的叙述正确的是( )
A.石墨烯可导电,说明它是电解质
B.石墨烯、金刚石、C60都是碳的单质
C.金刚石与石墨烯互为同位素
D.![]() C与
C与![]() C为不同的核素,有不同的化学性质
C为不同的核素,有不同的化学性质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com