
【题目】NA为阿伏加德罗常数的数值,下列有关叙述正确的是
A.32.5 g FeCl3水解所得的Fe(OH)3胶体粒子数为0.2NA
B.1 molCH4与足量Cl2在光照下反应生成的CH3Cl为NA
C.标准状况下,22.4 L苯含有NA个C6H6分子
D.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数为4 NA
科目:高中化学 来源: 题型:
【题目】化合物I是一种抗脑缺血药物,合成路线如下:
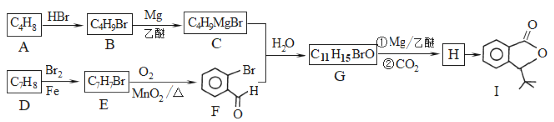
已知:
回答下列问题:
(1)按照系统命名法,A的名称是_____;写出A发生加聚反应的化学方程式:__________。
(2)反应H→I的化学方程式为________;反应E→F的反应类型是______。
(3)写出符合下列条件的G的所有同分异构体的结构简式:________
①遇FeCl3溶液发生显色反应 ②核磁共振氢谱有4组峰
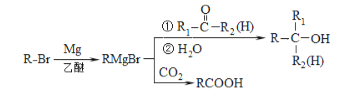
(4)α,α-二甲基苄醇(![]() )是合成医药、农药的中间体,以苯和2-氯丙烷为起始原料制备α,α-二甲基苄醇的合成路线如下:
)是合成医药、农药的中间体,以苯和2-氯丙烷为起始原料制备α,α-二甲基苄醇的合成路线如下:

该合成路线中X的结构简式为____,Y的结构简式为________;试剂与条件2为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水凝胶材料要求具有较高的含水率,以提高其透氧性能,在生物医学上有广泛应用。由N-乙烯基吡咯烷酮(NVP)和甲基丙烯酸![]() -羟乙酯(HEMA)合成水凝胶材料高聚物A的路线如图:
-羟乙酯(HEMA)合成水凝胶材料高聚物A的路线如图:
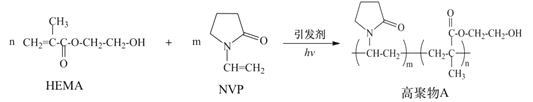
下列说法正确的是
A. NVP具有顺反异构
B. 高聚物A因含有-OH而具有良好的亲水性
C. HEMA和NVP通过缩聚反应生成高聚物A
D. 制备过程中引发剂浓度对含水率影响关系如图,聚合过程中引发剂的浓度越高越好

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)![]() 2C(g)+D(g)经2min后,B的浓度减少了0.6mol·L-1。下列说法正确的是( )
2C(g)+D(g)经2min后,B的浓度减少了0.6mol·L-1。下列说法正确的是( )
A.用A表示的化学反应速率是0.4mol·L-1·min-1
B.分别用B、C、D表示化学反应速率,其比是3∶2∶1
C.在2min末的反应速率用B表示是0.3mol·L-1·min-1
D.在这2min内B和C两物质的浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键断裂和新化学键形成的过程。化学键的键能是两个原子间形成1 mol化学键时释放的能量或断开1 mol化学键所吸收的能量。
现提供以下化学键的键能:(kJ·mol1)P—P:198 P—O:360 O==O:498 P==O:585。
则P4(白磷)+5O2![]() P4O10是___反应(填“放热”或“吸热”),能量变化为___kJ。(提示:白磷是正四面体形的分子,如图
P4O10是___反应(填“放热”或“吸热”),能量变化为___kJ。(提示:白磷是正四面体形的分子,如图 ,当与氧形成P4O10时,每两个磷原子之间插入一个氧原子,此外,每个磷原子又以双键结合一个氧原子)
,当与氧形成P4O10时,每两个磷原子之间插入一个氧原子,此外,每个磷原子又以双键结合一个氧原子)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国内某科技研究小组首次提出一种新型的Li+电池体系,该体系征集采用含有I-、Li+的水溶液,负极采用固体有机聚合物,电解质溶液采用LiNO3溶液,聚合物离子交换膜作为隔膜将液态正极和固态负极分隔开(原理示意图如图)。已知:I-+I2=I3-,则下列有关判断正确的是

A. 图甲是原电池工作原理图,图乙是电池充电原理图
B. 放电时,正极液态电解质溶液的颜色变浅
C. 充电时,Li+从右向左通过聚合物离子交换膜
D. 放电时,负极的电极反应式为:

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分:
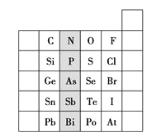
(1)阴影部分元素的外围电子排布式的通式为______。
(2)氮族元素氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质可能有________。
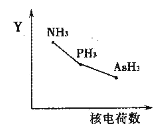
A.稳定性 B.沸点 C.R—H键能 D.分子间作用力
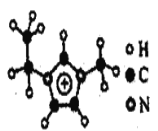
(3)如图EMIM+离子中,碳原子的杂化轨道类型为______。分子中的大π键可用符号πnm表示,其中n代表参与形成大π键的原子数,m代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),则EMM+离子中的大π键应表示为______。
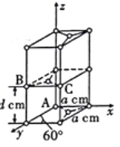
(4)晶胞有两个基本要素:石墨一种晶胞结构和部分晶胞参数如图。原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为A(0,0,0)、B(0,1,1/2),则C原子的坐标参数为___________。
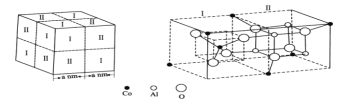
(5)钴蓝晶体结构如下图,该立方晶胞由4个I型和4个Ⅱ型小立方体构成,其化学式为___,晶体中Al3+占据O2-形成的__(填“四面体空隙”或“八面体空隙”)。NA为阿伏加德罗常数的值,钴蓝晶体的密度为____g·cm-3(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用以下流程从铜沉淀渣中回收铜、硒、碲等物质。某铜沉淀渣,其主要成分如表。沉淀渣中除含有铜(Cu)、硒(Se)、碲(Te)外,还含有少量稀贵金属,主要物质为Cu、Cu2Se和Cu2Te。某铜沉淀渣的主要元素质量分数如下:
Au | Ag | Pt | Cu | Se | Te | |
质量分数(%) | 0.04 | 0.76 | 0.83 | 43.47 | 17.34 | 9.23 |
(1)16S、34Se、52Te为同主族元素,其中34Se在元素周期表中的位置______。
其中铜、硒、碲的主要回收流程如下:

(2)经过硫酸化焙烧,铜、硒化铜和碲化铜转变为硫酸铜。其中碲化铜硫酸化焙烧的化学方程式如下,填入合适的物质或系数:Cu2Te+____H2SO4 ![]() 2CuSO4+____TeO2+____+____H2O
2CuSO4+____TeO2+____+____H2O
(3)SeO2与吸收塔中的H2O反应生成亚硒酸。焙烧产生的SO2气体进入吸收塔后,将亚硒酸还原成粗硒,其反应的化学方程式为______ 。
(4)沉淀渣经焙烧后,其中的铜转变为硫酸铜,经过系列反应可以得到硫酸铜晶体。
① “水浸固体”过程中补充少量氯化钠固体,可减少固体中的银(硫酸银)进入浸出液中,结合化学用语,从平衡移动原理角度解释其原因__________。
②滤液2经过、____ 、过滤、洗涤、干燥可以得到硫酸铜晶体。
(5)目前碲化镉薄膜太阳能行业发展迅速,被认为是最有发展前景的太阳能技术之一。用如下装置可以完成碲的电解精炼。研究发现在低的电流密度、碱性条件下,随着TeO32-浓度的增加,促进了Te的沉积。写出Te的沉积的电极反应式为___________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学想利用原电池反应检验金属的活动性强弱,两人均用镁片和铝片作电极,但甲同学将两电极放入6mol·L-1的H2SO4溶液中,乙同学将两电极放入6mol·L-1的NaOH溶液中,装置如图所示。

(1)写出图1中正极的电极反应式:_______________ 。
(2)图2中负极为_______________,总反应的离子方程式为____________。
(3)由该实验得出的下列结论中,正确的有 _______________(填序号)。
a.利用原电池反应判断金属活动性强弱时应注意原电池中的电解质溶液
b.镁的金属性不一定比铝的金属性强
c.该实验说明金属活动性顺序表已过时,没有实用价值
d.该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com