
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
| A.1:4 | B.1:2 | C.2:1 | D.4:1 |
科目:高中化学 来源: 题型:单选题
将Fe和Cu的混合粉末加入到100 mL 4 mol/L稀硝酸中充分反应后:
(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是 ,可能有的阳离子是 。
(2)若反应后的溶液中有Fe3+,则溶液中一定含有的阳离子是 ,可能含有的阳离子是 。
(3)如果反应后的溶液中无金属剩余,则加入的金属质量最大为 。
(4)如果加入的Fe和Cu的质量比为7∶8,则使HNO3完全反应的金属最小质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在100 mL等物质的量的HBr和H2SO3的混合液里通入0.01 mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于
| A.0.0075 mol·L-1 | B.0.008 mol·L-1 |
| C.0.075 mol·L-1 | D.0.08 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
4.6g铜镁合金完全溶解于100ml密度为1.40g/ml、质量分数为63%的浓硝酸中,得到4480mlNO2和336 ml N2O4的混合气体(标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液至离子恰好全部沉淀时,下列说法不正确的是 ( )
| A.该合金中铜与镁的物质的量之比是46:69 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L |
| C.产生沉淀8.51 g |
| D.离子恰好完全沉淀时,加入NaOH溶液的体积是230mL |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向一洁净干燥的烧杯中加入44.4gAl粉与Fe粉混合物,然后加入过量的盐酸,产生标况下气体26.88L。若将该混合物加入500mL14 mol·L-1的HNO3中(不考虑发生钝化),产生的气体(标准状况下测定)如图所示,假设HNO3的还原产物为NO与NO2,那么理论上从哪一时刻开始产生NO气体?(假设浓度小于9mol/L为稀HNO3)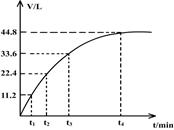
| A.t1 | B.t2 | C.t3 | D.t4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O = 7X+5FeSO4+12H2SO4,下列说法正确的是 ( )
| A.X的化学式为CuS,它既是氧化产物又是还原产物 |
| B.5 mol FeS2发生反应,有10 mol电子转移 |
| C.产物中的SO42-离子有一部分是氧化产物 |
| D.FeS2只作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:①向KMnO4固体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是( )
| A.上述实验证明氧化性:MnO4->Cl2>Fe3+>I2 |
| B.上述实验中,共有两个氧化还原反应 |
| C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝 |
| D.实验②证明Fe2+既有氧化性又有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
Na2FeO4是一种高效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是( )
| A.Na2O2在上述反应中只作氧化剂 |
| B.Na2FeO4既是氧化产物又是还原产物 |
| C.Na2FeO4处理水时,既能杀菌,又能在处理水时产生胶体净水 |
| D.2 mol FeSO4发生反应时,共有10 mol电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现取m g镁铝合金在一定浓度的稀硝酸中恰好完全溶解(硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol·L-1 NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n g,则下列有关该实验的说法中正确的有( )。
①沉淀中OH-的质量为(n-m)g
②恰好溶解后溶液中的NO的物质的量为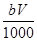 mol
mol
③反应过程中转移的电子数为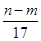 mol
mol
④标准状况下生成NO的体积为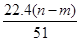 L
L
⑤与合金反应的硝酸的物质的量为(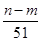 +
+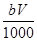 )mol
)mol
| A.5项 | B.4项 | C.3项 | D.2项 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com