
在100 mL等物质的量的HBr和H2SO3的混合液里通入0.01 mol Cl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于
| A.0.0075 mol·L-1 | B.0.008 mol·L-1 |
| C.0.075 mol·L-1 | D.0.08 mol·L-1 |
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:单选题
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的危害,必须进行处理。下面是一种处理方法的工业流程: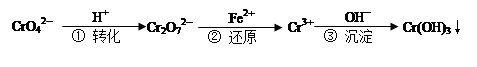
下列说法正确的是:
| A.改变反应①的平衡体系中c(H+)浓度,溶液颜色无明显变化 |
| B.若2v (Cr2O72—) ="v" (CrO42—),说明反应①达平衡状态 |
| C.反应②中还原1mol Cr2O72—,需要6 mol的Fe2+ |
D.FeSO4溶液呈酸性的原因是Fe2++ 2H2O  Fe(OH) 2↓+ 2H+ Fe(OH) 2↓+ 2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法中正确的是( )
| A.含有金属元素的离子一定是阳离子,金属阳离子被还原一定得到金属单质 |
| B.pH相等的NaOH、NaHCO3和Na2CO3三种溶液: c(NaOH)<c(NaHCO3)<c(Na2CO3) |
| C.常温下,c(NH4+)相等的4种溶液:①(NH4)2SO4②(NH4)2Fe(SO4)2③NH4Cl ④(NH4)2CO3,溶质物质的量浓度大小关系是:②<①<④<③ |
| D.某温度时水的离子积常数KW=10-13若将此温度下pH=11的NaOH溶液aL与pH=1的稀硫酸bL混合,若所得混合液pH=2,则a:b=2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。下列有关说法不正确的是( )
| A.Cu与Cu2O的物质的量之比为2∶1 |
| B.硝酸的物质的量浓度为2.6 mol·L-1 |
| C.产生的NO在标准状况下的体积为4.48 L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以金红石为原料制取Ti的反应为:
aTiO2+bCl2+cC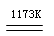 aTiCl4+cCO……反应①
aTiCl4+cCO……反应①
TiCl4+2Mg Ti+2MgCl2……反应②
Ti+2MgCl2……反应②
关于反应①②的分析不正确的是( )
A.TiCl4在反应①中是还原产物,在反应②中是氧化剂
B.C、Mg在反应中均为还原剂,被氧化
C.每生成0.4 mol Ti,反应①②中共转移3.2 mol e-
D.反应①②都是置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O,下列说法正确的是( )
| A.由反应可知,氧气、氯气均为氧化产物 |
| B.若化学计量数a=8,则该反应转移电子数为12e- |
| C.若b确定,则方程式中其他物质的化学计量数均能确定 |
| D.若氯酸分解所得混合气体,1 mol混合气体质量为51.5 g,则反应方程式可表示为:5HClO3=O2↑+Cl2↑+3HClO4+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
若(NH4)2SO4在强热时分解的产物是SO2、N2、NH3和H2O,则该反应中化合价发生变化和未发生变化的N原子数之比为( )
| A.1:4 | B.1:2 | C.2:1 | D.4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据表中信息,判断下列叙述中正确的是 ( )。
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | Fe3+、Br2 | |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将一定量的Fe和Fe2O3的混合物放入250 mL、1.8 mol·L-1的HNO3溶液中,当固体混合物完全溶解后,在标准状况下生成1.12 L NO(HNO3的还原产物仅此一种),再向反应后的溶液中加入1.0 mol·L-1 NaOH溶液,若要使铁元素完全沉淀,所加入的NaOH溶液的体积最少应为( )
| A.300 mL | B.400 mL | C.450 mL | D.500 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com