
����Ŀ��ijѧ����0.2000mol��L��1�ı�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬ��������£�
��������ˮϴ�Ӽ�ʽ�ζ��ܣ�ע��0.2000mol��L��1�ı�NaOH��Һ����0���̶������ϣ�
�ڹ̶��õζ��ܲ�ʹ�ζ��ܼ������Һ�壻
�۵���Һ������ 0������0���̶������£������¶�����
����ȡ20.00mL����Һע��ྻ����ƿ�У�������3�η�̪��Һ��
���ñ�Һ�ζ����յ㣬���µζ���Һ�������
���ظ����ϵζ�����2-3�Σ�
��ش��������⣺
��1�����ϲ����д�����ǣ����ţ�_____________���ô�������ᵼ�²ⶨ���_________ (����ƫ��������ƫС��������Ӱ����)��
��2��������У���ȡ20.00mL����ҺӦʹ��________________ (����������)������ƿװҺǰ��������������ˮ���ⶨ���____________��������������ƫС��������Ӱ��������
��3������ݵζ�ʱ�۾�Ӧע��_______________________���жϵ���ζ��յ��������_______��
��4��������ʵ�����ݼ�¼��
�ζ����� | ���������mL�� | NaOH��Һ���������mL�� | |
�ζ�ǰ | �ζ��� | ||
1 | 20.00 | 0.00 | 18.10 |
2 | 20.00 | 0.00 | 16.30 |
3 | 20.00 | 0.00 | 16.22 |
���ϱ����Կ�������1�εζ���¼��NaOH��Һ������Զ��ں����ε����������ܵ�ԭ������______��
A���ζ�ǰ�ζ��ܼ��������ݣ��ζ�����������
B����ƿ�ô���Һ��ϴ
C��NaOH��Һ����ʱ��������в��ֱ���
D���ζ�����ʱ�����Ӷ���
��5�������ϱ���¼���ݣ�ͨ������ɵã�������Ũ��Ϊ____________mol��L��1

��6�������£���0.100mol/L NaOH��Һ�ֱ�ζ�20.00mL0.100mol/L������ʹ��ᣬ�ζ�������ͼ��ʾ������˵����ȷ������______��
A������ʾ���ǵζ����������
B��pH=7ʱ���ζ���������V(NaOH)С��20mL
C��V(NaOH) =20mLʱ��c( Cl�� )=c(CH3COO�� )
D��V(NaOH) =10mLʱ��������Һ�У�c( Na+ )�� c(CH3COO��)�� c( H+ )�� c(OH��)
���𰸡� �� ƫ�� ��ʽ�ζ��� ��Ӱ�� ��ƿ����Һ��ɫ�ı仯 ��ƿ����Һ����ɫ��Ϊdz��ɫ�Ұ�����ڲ���ɫ AB 0.1626 B
����������1�����ݼ�ʽ�ζ�����װҺǰӦ�ô�װҺ������ϴ��������������ˮϴ�Ӽ�ʽ�ζ��ܣ�������ע��NaOH��Һ����0���̶������ϣ���ʽ�ζ���δ�ñ�NaOH��Һ��ϴ��ֱ��ע���NaOH��Һ����Һ��Ũ��ƫС�����V������ƫ����c�����⣩=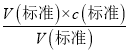 ��c�����⣩ƫ��2���������о�ȷ��ȡҺ�������õζ��ܣ���ȡ20.00mL����Һ(HCl)Ӧʹ����ʽ�ζ��ܣ�����ƿװҺǰ��������������ˮ��V���������䣬����c�����⣩=
��c�����⣩ƫ��2���������о�ȷ��ȡҺ�������õζ��ܣ���ȡ20.00mL����Һ(HCl)Ӧʹ����ʽ�ζ��ܣ�����ƿװҺǰ��������������ˮ��V���������䣬����c�����⣩=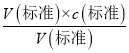 ��c���������䣬c�����⣩���䣬������ƿװҺǰ��������������ˮ�Բⶨ�����Ӱ�죻��3���к͵ζ��У��۾�Ӧע�ӵ�����ƿ����Һ��ɫ�仯���ζ�ʱ������Һ��ɫ�仯�Ұ�����ڲ���ɫ����˵���ﵽ�ζ��յ㣬���Ե��������һ�����ᣬ��Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ����4�����ϱ����Կ�������1�εζ���¼��NaOH��Һ������Զ��ں����ε�����������õ�����Ũ��ƫ�����ζ�ǰ�ζ��ܼ��������ݣ��ζ����������ݣ���������������Һ���ƫ��������������Ũ��ƫ�� A����ȷ����ƿ�ô���Һ��ϴ������Һ�����ʵ���ƫ����������������Һ���ƫ����������Ũ��ƫ��B����ȷ��NaOH��Һ����ʱ��������в��ֱ��ʣ���������������Һ���ƫС����������Ũ��ƫС��C����ζ�����ʱ�����Ӷ�������������������Һ���ƫС����������Ũ��ƫС��D���������5�����εζ����ĵ����Ϊ��18.10mL��16.30mL��16.22 mL����ȥ��1�����ݣ�Ȼ�����2��3��ƽ������V��NaOH��=16.26mL��c�����⣩=
��c���������䣬c�����⣩���䣬������ƿװҺǰ��������������ˮ�Բⶨ�����Ӱ�죻��3���к͵ζ��У��۾�Ӧע�ӵ�����ƿ����Һ��ɫ�仯���ζ�ʱ������Һ��ɫ�仯�Ұ�����ڲ���ɫ����˵���ﵽ�ζ��յ㣬���Ե��������һ�����ᣬ��Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ����4�����ϱ����Կ�������1�εζ���¼��NaOH��Һ������Զ��ں����ε�����������õ�����Ũ��ƫ�����ζ�ǰ�ζ��ܼ��������ݣ��ζ����������ݣ���������������Һ���ƫ��������������Ũ��ƫ�� A����ȷ����ƿ�ô���Һ��ϴ������Һ�����ʵ���ƫ����������������Һ���ƫ����������Ũ��ƫ��B����ȷ��NaOH��Һ����ʱ��������в��ֱ��ʣ���������������Һ���ƫС����������Ũ��ƫС��C����ζ�����ʱ�����Ӷ�������������������Һ���ƫС����������Ũ��ƫС��D���������5�����εζ����ĵ����Ϊ��18.10mL��16.30mL��16.22 mL����ȥ��1�����ݣ�Ȼ�����2��3��ƽ������V��NaOH��=16.26mL��c�����⣩=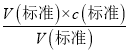 =
=![]() =0.1626 mol��L��1����6���ζ���ʼʱ0.1000mol/L����pH=1��0.1000mol/L����pH��1�����Եζ������������ͼ�ζ������������ͼ��A���������ˮ��ʼ��ԣ��Ȼ��Ʋ�ˮ�⣬pH=7ʱ����������NaOH��Һ�����С��20mL��B����ȷ��V��NaOH��=20.00mLʱ�����߷�Ӧ�����Ȼ��ƺʹ����ƣ����������ˮ�⣬Ũ��С�������ӣ���c( Cl�� )> c(CH3COO�� )��C�������10ml��������ʱ����Һ��ǡ��ΪͬŨ�ȵĴ���ʹ����ƣ����������ڴ������ˮ��̶ȣ���c(CH3COO��)��c( Na+ )�� c( H+ )�� c(OH��) ��D�����
=0.1626 mol��L��1����6���ζ���ʼʱ0.1000mol/L����pH=1��0.1000mol/L����pH��1�����Եζ������������ͼ�ζ������������ͼ��A���������ˮ��ʼ��ԣ��Ȼ��Ʋ�ˮ�⣬pH=7ʱ����������NaOH��Һ�����С��20mL��B����ȷ��V��NaOH��=20.00mLʱ�����߷�Ӧ�����Ȼ��ƺʹ����ƣ����������ˮ�⣬Ũ��С�������ӣ���c( Cl�� )> c(CH3COO�� )��C�������10ml��������ʱ����Һ��ǡ��ΪͬŨ�ȵĴ���ʹ����ƣ����������ڴ������ˮ��̶ȣ���c(CH3COO��)��c( Na+ )�� c( H+ )�� c(OH��) ��D�����
�㾦: ��������ԭ��:����ԭ��c����V����c������V����������c������![]() ����Ϊc����V������ȷ�������ֻҪ����������ȷ��������V���ı仯���������������
����Ϊc����V������ȷ�������ֻҪ����������ȷ��������V���ı仯���������������


 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��пͭԭ���װ����ͼ��ʾ�����������ӽ���Ĥֻ���������Ӻ�ˮ����ͨ���������й���������ȷ���ǣ� �� 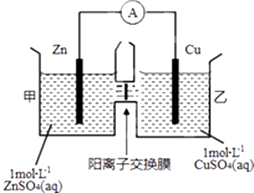
A.Zn�缫�Ϸ���������Ӧ
B.���ӵ�����ΪZn����������Cu
C.SO42�����ҳ�ͨ�����ӽ���Ĥ��׳��ƶ�
D.��ع���һ��ʱ����ҳ���Һ����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڸ�ͼ��Ľ��ͻ������ȷ���ǣ� ��
A.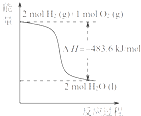 �Ȼ�ѧ����ʽ��H2��g��+
�Ȼ�ѧ����ʽ��H2��g��+ ![]() O2��g��=H2O��g����H=��241.8 kJ/mol
O2��g��=H2O��g����H=��241.8 kJ/mol
B.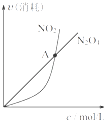 ���ں��º��������µķ�Ӧ2NO2��g��?N2O4��g����A��Ϊƽ��״̬
���ں��º��������µķ�Ӧ2NO2��g��?N2O4��g����A��Ϊƽ��״̬
C.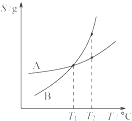 ��A,B������Һ�ֱ���T1��������T2��ʱ�����ʵ���������B��A
��A,B������Һ�ֱ���T1��������T2��ʱ�����ʵ���������B��A
D.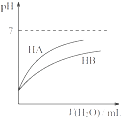 ͬ�¶ȡ�ͬŨ�ȵ�NaA��Һ��NaB��Һ��ȣ���pHǰ��С�ں���
ͬ�¶ȡ�ͬŨ�ȵ�NaA��Һ��NaB��Һ��ȣ���pHǰ��С�ں���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��HA��HB���������Һ�ֱ��ˮϡ��ʱ��pH�仯�ļ�ͼ��ͼ��ʾ�����������в���ȷ���ǣ� ��

A. HA��һ��ǿ��
B. x�㣬c(A��)��c(B��)
C. HB��һ������
D. ԭ��Һ��HA�����ʵ���Ũ��ΪHB��10��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������һ������ͬϵ�����(����)
A.CH4��C2H4
B.�����ͻ�����
C.C2H4��C4H8
D.C5H12��C3H8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ӣ���ǿ������Һ���ܴ���������ǣ� ��
A. Na+��Ba2+��Cl-��SO42-B. Na+��Ba2+��AlO2-��NO3-
C. NH4+��K+��Cl-��NO3-D. Na+��K+��SiO32-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȼҵ�������ð������������������ܵ��Ƿ�й©����������������������̣�
��1����Ӧ��������һ��������̬���ʣ�д����Ӧ�Ļ�ѧ����ʽ��
��2���ڸ÷�Ӧ�У��������� �� ��ԭ������ �� ����0.017g����������ʱ��ת�Ƶĵ�����ĿΪ ��
��3����ʽ���㵱��112mL�������㵽��״���£������μӷ�Ӧʱ���ɵİ��̵�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȱ������Ǻϳɷ�����������ʹҩ���м��壬��������ȼ�Ϻ�Ũҩ�ĺϳɣ�ʵ�������Ʊ����ȱ�����ķ�Ӧ��װ��ͼ��ͼ2�� 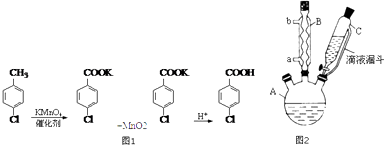
���������µ��й����������ʾ��
��Է������� | �۵�/�� | �е�/�� | �ܶ�/gcm��3 | ��ɫ | ˮ���� | |
���ȼױ� | 126.5 | 7.5 | 162 | 1.07 | ��ɫ | ���� |
���ȱ����� | 156.5 | 243 | 275 | 1.54 | ��ɫ | �� |
���ȱ������ | 194.5 | �����ε�ͨ�ԣ����ڿ������� | ||||
ʵ�鲽�裺�ڹ��Ϊ250mL��װ��A�м���һ�����Ĵ���������KMnO4��100mLˮ����װ��װ�ã��ڵ�Һ©���м���6.00mL���ȼױ������¶�Ϊ93������ʱ����ε�����ȼױ��������¶���93�����ң���Ӧ2h�����ˣ�����������ˮϴ�ӣ�ʹϴ��Һ����Һ�ϲ�������ϡ�����ữ������Ũ����Ȼ����ˣ�����������ˮ����ϴ�ӣ���������������Ϊ7.19g��
��ش��������⣺
��1��װ��B�������� ��
��2����ȡ6.00mL���ȼױ�Ӧѡ�õ������� �� ����ѡ������ţ���
A.10mL��Ͳ
B.50mL����ƿ
C.50mL��ʽ�ζ���
D.50mL��ʽ�ζ���
��3�������¶�Ϊ93�����ҵķ����� �� ���ȼױ��ļ��뷽������μ��������һ���Լ��룬ԭ���� ��
��4����һ�ι��˵�Ŀ���� �� ��Һ�м���ϡ�����ữ���ɹ۲쵽��ʵ�������� ��
��5���ڶ��ι�����������Ҫ����ˮ����ϴ�ӣ���ԭ���� ��
��6����ʵ��IJ����������ţ���
A.60%
B.70%
C.80%
D.90%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.��ϵͳ�������� ![]() ��������2��3�����һ�����
��������2��3�����һ�����
B.ij����������A�ķ���ʽΪC6H12O2 �� ��֪  ����֪D����NaHCO3��Һ��Ӧ��C��E�����ܷ���������Ӧ����A�Ľṹ������4��
����֪D����NaHCO3��Һ��Ӧ��C��E�����ܷ���������Ӧ����A�Ľṹ������4��
C.��ȫȼ����̼ͬԭ�ӡ�����ͬ������������ϩ����Ȳ��������������������
D.��֪��A�ķ���ʽΪC5Hm �� ��B�����ʽΪC5Hn��m��n��Ϊ��������������A����B�����ܻ�Ϊͬϵ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com