
【题目】下列说法正确的是
A.配制硫酸亚铁溶液时,常向溶液加入少量稀硝酸和少量铁粉
B.用25.00mL碱式滴定管量取20.00mL酸性高锰酸钾溶液
C.用pH试纸检验气体的酸碱性时,一定要先用蒸馏水湿润
D.可以用洒精萃取碘水中的碘单质
科目:高中化学 来源: 题型:
【题目】合成氨工业对化学工业和国防工业具有重要意义,对农业生产起着重要作用。
(1)已知:N2(g)+O2(g)=2NO(g) △H1
H2(g)+1/2O2(g)=H2O(1) △H2
4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H3
N2(g)+3H2(g)2NH3(g) △H4<0
则△H4= (用含△H1、△H2、△H3的代数式表示)。
(2)在其他条件相同时,分别测定合成氨反应中N2的平衡转化率随压强变化的曲线如下图A、B所示,其中正确的是 (填“A”或“B”),其判断理由是 。
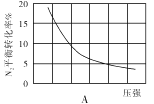
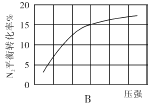
(3)在体积为2L的密闭容器中按物质的量1:3的比例充入N2、H2,进行下列四组合成氨实验:
组别 | 温度 | N2起始量/mol | N2的物质的量/mol | ||||||
5(s) | 10(s) | 15(s) | 20(s) | 25(s) | 30(s) | 35(s) | |||
Ⅰ | T1 | 0.1 | 0.094 | 0.089 | 0.085 | 0.0825 | 0.081 | 0.080 | 0.080 |
Ⅱ | T2 | 0.1 | 0.090 | 0.085 | 0.082 | 0.080 | 0.080 | 0.080 | 0.080 |
Ⅲ | T3 | 0.2 | 0.179 | 0.165 | 0.153 | 0.146 | x | x | x |
Ⅳ | T4 | 0.2 | 0.173 | 0.161 | 0.155 | 0.150 | 0.150 | 0.150 | 0.150 |
①实验Ⅰ前10秒的平均速率v(NH3)= mol·L-1·s-1,T1温度下合成氨反应的平衡常数K= (列出计算式)。
②与实验Ⅰ相比,实验Ⅱ改变了一个条件,该条件可能是 。
③与实验I相比,实验Ⅲ中N2的平衡转化率 (填“增大”、“减小”或“不变”),平衡常数K (填“增大”、“减小”或“不变”)。
④实验Ⅲ与实验Ⅳ的反应条件温度不同,则T1 (填“大于”、“小于”或“等于”)T2,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法没有科学性错误的是 ( )
A. “白雪牌”漂白粉可令所有有色物质黯然失“色”,没有最白,只有更白
B. CO有毒,生有煤炉的居室,可放置数盆清水,这样可有效地吸收CO,防止煤气中毒
C. 氯化钙具有吸水性和潮解性,夏日里用它的水溶液喷洒柏油路,可有效地保护路面
D. 氯元素有毒,禁止放入口中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
请回答下列问题:
(1)该反应的化学平衡常数表达式K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)830℃,在1L的固定容器的密闭容器中放入1 mol CO和5 mol H2O,反应达平衡后,其化学平衡常数K 1.0(填“大于”、“小于”或“等于”)
(4)830℃,容器中的反应达到平衡。在其他条件不变的情况下,扩大容器的体积,平衡 移动。(填“向正方向”、“向逆方向”或“不”)
(5)若1200℃时,在某时刻该容器中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为 (选填“正反应方向”、“逆反应方向”、“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A.臭氧具有氧化性,可用作自来水的消毒剂
B.活性炭具有还原性,可用作制糖业脱色剂
C.氢氟酸具有弱酸性,可用作玻璃的蚀刻剂
D.氨气具有弱碱性,可用作食品工业制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生化学反应H2(g)+I2(g)2HI(g),05min内H2的浓度减少了0.1mol/L,则在这段时间内,用HI表示的平均反应速率为( )
A.0.01molL-1min-1 B.0.2molL-1min-1
C.0.04molL-1min-1 D.0.5molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)氧化—还原法消除氮氧化物的转化如下:![]()
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是_____。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=-41.8 kJ·mol-1
SO3(g)+NO(g) △H=-41.8 kJ·mol-1
已知:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6 kJ·mol-1,写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) △H=-196.6 kJ·mol-1,写出NO和O2反应生成NO2的热化学方程式 。
(3)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料。
①以尿素为原料一定条件下发生反应:CO(NH2)2 (s) + H2O(l)![]() 2 NH3(g)+CO2(g) △H = +133.6 kJ/mol。该反应的化学平衡常数的表达式K= 。关于该反应的下列说法正确的是 (填序号)。
2 NH3(g)+CO2(g) △H = +133.6 kJ/mol。该反应的化学平衡常数的表达式K= 。关于该反应的下列说法正确的是 (填序号)。
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度使尿素的转化率增大
②密闭容器中以等物质的量的NH3和CO2为原料,在120 ℃、催化剂作用下反应生成尿素:CO2(g) +2NH3(g)![]() CO (NH2)2 (s) +H2O(g),混合气体中NH3的物质的量百分含量[(NH3)]随时间变化关系如图所示。则a点的正反应速率V(正)(CO2) b点的逆反应速率V(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是 。
CO (NH2)2 (s) +H2O(g),混合气体中NH3的物质的量百分含量[(NH3)]随时间变化关系如图所示。则a点的正反应速率V(正)(CO2) b点的逆反应速率V(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R有如下反应:RO3-+5R-+6H+=3R2+3H2O,下列说法正确的是
A.元素R位于周期表中第ⅦA族
B.RO3-中的R只能被还原
C.R2在常温常压下一定是气体
D.每反应消耗1 mol RO3-,转移电子的物质的量为5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的固体废渣中主要含Cu和CuO,还含有少量Cu2O和SiO2等。利用该固体废渣制取Cu (NO3)2的部分工艺流程如图所示:

(1)Cu2O与稀硝酸反应的离子方程式为 。
(2)酸溶时,反应温度不宜超过70℃,其主要原因是 ,若保持反应温度为70℃,欲加快反应速率可采取的措施为 (写出一种即可)。
(3)过滤后所得废渣的主要成分的化学式为 。
(4) Cu(NO3)2晶体受热易分解成CuO,同时产生NO2和O2,该反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com