
【题目】下列反应中,属于氧化还原反应且反应前后能量变化如图所示的是( ) 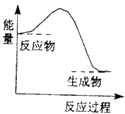
A.生石灰溶于水
B.高温条件下铝与氧化铁的反应
C.高温条件下碳粉与二氧化碳的反应
D.Ba(OH)28H2O晶体与NH4Cl固体的反应
科目:高中化学 来源: 题型:
【题目】下列反应中,一定不能自发进行的是
A.2KClO3(s)![]() 2KCl (s)+3O2 (g) ΔH= 78. 03 kJ· mol1 ΔS=+1 110 J/(mol·K)
2KCl (s)+3O2 (g) ΔH= 78. 03 kJ· mol1 ΔS=+1 110 J/(mol·K)
B.CO(g)![]() C(石墨,s)+
C(石墨,s)+![]() O2(g) ΔH=+ 110. 5 kJ· mol1 ΔS=89.36 J/(mol·K)
O2(g) ΔH=+ 110. 5 kJ· mol1 ΔS=89.36 J/(mol·K)
C.4Fe(OH)2(s)+2H2O(l)+O2(g)![]() 4Fe(OH)3(s) ΔH=444.3 kJ·mol1 ΔS=280.1 J/(mol·K)
4Fe(OH)3(s) ΔH=444.3 kJ·mol1 ΔS=280.1 J/(mol·K)
D.NH4HCO3(s)+ CH3COOH(aq) ![]() CO2(g)+ CH3COONH4 (aq)+H2O(l) ΔH=+37.3 kJ·mol1 ΔS=+184.0 J/(mol·K)
CO2(g)+ CH3COONH4 (aq)+H2O(l) ΔH=+37.3 kJ·mol1 ΔS=+184.0 J/(mol·K)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年11月30日至12月11日,世界各国领导人在巴黎共同商讨如何应对气候变化、提升经济绿色水平,实现人类可持续发展。要想提升经济绿色水平下列属于最有希望的新能源是( )
①天然气 ②煤 ③石油 ④水能 ⑤太阳能 ⑥地热能 ⑦风能 ⑧氢能
A. ①②③④ B. ⑤⑥⑦⑧ C. ③④⑤⑥ D. 除①②外
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,互为同系物的是( )
A.![]() 与
与![]() B.CH3(CH2)4CH3与(CH3)2CHCH(CH3)2
B.CH3(CH2)4CH3与(CH3)2CHCH(CH3)2
C.C17H35COOH与C15H31COOH D.CH3OH与HOCH2CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、钾的碘化物在生产和科学实验中有十分重要的应用。工业上利用碘、烧碱和铁屑为原料可生产碘化钠,其生产流程如图所示:

(1)NaOH溶液和碘反应时需要严格控制温度,如果温度过低,会生成碘的低价副产品NaIO。若NaOH溶液和碘反应时所得溶液中IO3-与IO-的物质的量之比为1:1,则该反应的离子方程式为________________________________。
(2)生产流程中加入过量铁屑的目的是___________________,过滤所得固体中除剩余铁屑外,还有红褐色固体,则加入铁屑时发生反应的化学方程式是_________。
(3)溶液2中除含有H+外,一定含有的阳离子是__________________;试设计实验证实该金属阳离子的存在:____________________________。
(4)溶液2经一系列转化可以得到草酸亚铁晶体(FeC2O4·2H2O),称取3.60g草酸亚铁晶体用热重法对其进行热分解,得到剩余固体的质量随温度变化的曲线如图所示:

①分析图中数据,写出过程I发生反应的化学方程式:__________________________;
②300℃时剩余固体是铁的一种氧化物,通过计算确定该氧化物的化学式: ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境。某化学兴趣小组对废气A的组成进行探究,请回答下列问题。
(1)同学甲设计实验检验废气A中含有CO2,应选择的试剂有_________。
A.NaOH溶液 B.酸性KMnO4溶液 C.澄清石灰水 D.盐酸
(2)同学乙欲测定废气A中SO2的含量,取a L废气A并设计了如下装置进行实验。

①为了保证实验成功,装置A应具有的现象是___________,搅拌的目的是___________。
②同学丙认为A装置前后的质量差就是a L废气中含有的SO2的质量,然后进行含量计算。经小组讨论后,同学丁提出疑问,按照同学丙的实验,若废气中SO2完全被吸收,则最后测定的结果应该偏大,同学丁推断的理由是_______________________________。
(3)兴趣小组的同学查阅资料发现可利用硫酸工业废气A制备皓矾(ZnSO4·7H2O)。实验模拟制备皓矾工业流程如下:

①氧化中加入硫酸铁发生反应的离子方程式是____________________。
②加入Zn粉的目的是_________________________________。
③固体A主要成分是__________________。
④操作b得到纯净皓矾晶体,必要的操作是蒸发浓缩、__________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒(V2O5)是重要的催化剂,可用某钒矿石(含有 V2O3、Fe、Al2O3等)来制备,工艺流程如下:
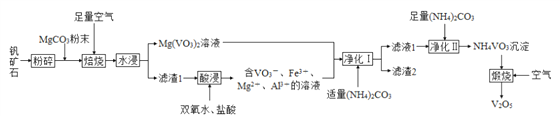
请回答下列问题:
(1) 钒矿石“粉碎”的目的为__________。
(2)“滤渣1” 中除 Al2O3、 Fe(VO3)2、 Fe(VO3)3外,还含有__________(填化学式)。
(3)“酸浸”时,若用硝酸代替双氧水和盐酸,弊端为__________。
(4)“滤渣 2” 的主要成分为 MgCO3、Fe(OH)3和 Al(OH)3,其中生成 Al(OH)3的离子方程式为__________。
(5) 若“净化Ⅰ” 时直接加入足量的(NH4)2CO3,可能导致的后果为__________。
(6)“煅烧”时,还生成参与大气循环的气体,该反应的化学方程式为__________。
(7)产品中 V2O5纯度的测定: 称取产品 a g, 先用硫酸溶解,得到(VO2)2SO4溶液;再加入 V1 mL c1 mol·L-1 (NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+=VO2++Fe3++H2O); 最后用 c2 mol·L-1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗 KMnO4标准溶液的平均体积为 V2 mL。假设杂质不参与反应,则产品中 V2O5的质量分数为__________%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com