
【题目】硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境。某化学兴趣小组对废气A的组成进行探究,请回答下列问题。
(1)同学甲设计实验检验废气A中含有CO2,应选择的试剂有_________。
A.NaOH溶液 B.酸性KMnO4溶液 C.澄清石灰水 D.盐酸
(2)同学乙欲测定废气A中SO2的含量,取a L废气A并设计了如下装置进行实验。

①为了保证实验成功,装置A应具有的现象是___________,搅拌的目的是___________。
②同学丙认为A装置前后的质量差就是a L废气中含有的SO2的质量,然后进行含量计算。经小组讨论后,同学丁提出疑问,按照同学丙的实验,若废气中SO2完全被吸收,则最后测定的结果应该偏大,同学丁推断的理由是_______________________________。
(3)兴趣小组的同学查阅资料发现可利用硫酸工业废气A制备皓矾(ZnSO4·7H2O)。实验模拟制备皓矾工业流程如下:

①氧化中加入硫酸铁发生反应的离子方程式是____________________。
②加入Zn粉的目的是_________________________________。
③固体A主要成分是__________________。
④操作b得到纯净皓矾晶体,必要的操作是蒸发浓缩、__________、过滤、洗涤、干燥。
【答案】 BC KMnO4溶液的紫红色不能完全褪色 提高SO2的吸收率 可能有部分SO2被O2氧化使溶液质量增加 2Fe3++ SO2+ 2H2O=2 Fe2++SO42-+4H+ 除溶液中的Fe2+、Fe3+等 Fe、Zn(或铁、锌) 结晶
【解析】试题分析:(1)硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境,设计实验检验废气A中含有的CO2,需要除去二氧化硫,避免干扰二氧化碳的检验,除净二氧化硫的气体通过澄清石灰水检验二氧化碳的存在,石灰水变浑浊证明含有二氧化碳,所以A中为高锰酸钾溶液,B中为澄清石灰水;故答案为:BC。
(2)①为了保证实验成功需要在A装置中用高锰酸钾溶液全部吸收,高锰酸钾溶液不褪色证明二氧化硫吸收完全,搅拌的主要作用是充分吸收二氧化硫,提高吸收率;
故答案为:KMnO4溶液的紫红色不能完全褪色;提高SO2的吸收率;
②按照同学丙的实验,若废气中SO2完全被吸收,测定的结果应该偏大,可能是生成的亚硫酸被气体中氧气氧化,实验过程中发生2H2SO3+O2=2H2SO4,导致测定气体质量增大;
故答案为:2H2SO3+O2=2H2SO4;
(3)废气净化后加入硫酸铁氧化二氧化硫为硫酸,硫酸铁被还原为硫酸亚铁,加入过量锌粉还原亚铁离子和铁离子,得到固体A为锌和铁,滤液为硫酸锌溶液,通过蒸发浓缩,冷却结晶,过滤洗涤干燥等步骤得到硫酸锌晶体;
①“氧化”中加入硫酸铁发生反应是和其他中二氧化硫发生还会有反应生成硫酸亚铁和硫酸,反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
②加入过量锌粉还原亚铁离子和铁离子,除溶液中Fe2+、Fe3+等,故答案为:除溶液中的Fe2+、Fe3+等;
③分析可知固体A为锌和铁;故答案为:Zn、Fe;
④操作b是溶液中得到纯净皓矾晶体,必要的操作为:冷却结晶,过滤洗涤,干燥等步骤得到;
故答案为:蒸发(浓缩)、降温(结晶);


科目:高中化学 来源: 题型:
【题目】如下图所示,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试完成以下问题:

(1)电源A极的名称是________。
(2)甲装置中电解反应的总化学方程式是________________________。
(3)如果收集乙装置中产生的气体,两种气体的体积比是________。
(4)欲用丙装置给铜镀银,G应该是____(填“铜”或“银”),电镀液的主要成分是______(填化学式)。
(5)装置丁中的现象是_________________,说明_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于氧化还原反应且反应前后能量变化如图所示的是( ) 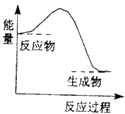
A.生石灰溶于水
B.高温条件下铝与氧化铁的反应
C.高温条件下碳粉与二氧化碳的反应
D.Ba(OH)28H2O晶体与NH4Cl固体的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)如图是某种只含有C、H、O、N的有机物简易球棍模型。

请回答下列各题。
(1)该分子属氨基酸,其分子式为________。
(2)在一定条件下,该分子可以通过聚合反应生成________(填“糖类”“油脂”或“蛋白质”)。
(3)在一定条件下,该分子可以与乙醇发生反应,请写出该反应的化学方程式_________________________________。
(4)对该有机物性质的描述中,正确的是________ (填写选项的字母)。
a.能与![]() 溶液反应 b.具有两性
溶液反应 b.具有两性
c.能发生水解反应 d.一定条件下能发生聚合反应
(二)白藜芦醇(结构如右图 )具有抗癌性。请回答下列问题。
)具有抗癌性。请回答下列问题。
(1)1 mol该有机物最多消耗________mol NaOH。
(2)1 mol该有机物与Br2反应时,最多消耗________mol Br2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇在浓硫酸的作用下,加热到170℃时生成乙烯。某实验小组同学根据此反应设计了右图装置制取乙烯。
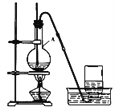
请回答:
(1)仪器A的名称是________________;
(2)加热前烧瓶中应加入碎瓷片,其目的是__________________;
(3)该反应的化学方程式为___________________________________,反应类型是________(填序号)。
a.加成反应 b.消去反应
(4)将生成的乙烯通入高锰酸钾酸性溶液中,观察到的现象是_______。(填序号)
a.溶液紫色褪去 b.没有明显现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其他产物已略去)。下列说法不正确的是
![]()
A. 若W是单质铁,则Z溶液可能是FeCl2溶液
B. 若W是氢氧化钠,则X与Z可反应生成Y
C. 若X是金属镁,则W可能是强氧化性的单质
D. 若X是金属Na,则Z可以是Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】38.4g铜跟适量的浓硝酸反应,铜全部作用后,共收集到22.4L(标准状况)气体.则反应消耗HN03的物质的量可能是( )
A.1 mol
B.1.6 mol
C.2.2 mol
D.2.4 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com