
【题目】如下图所示,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试完成以下问题:

(1)电源A极的名称是________。
(2)甲装置中电解反应的总化学方程式是________________________。
(3)如果收集乙装置中产生的气体,两种气体的体积比是________。
(4)欲用丙装置给铜镀银,G应该是____(填“铜”或“银”),电镀液的主要成分是______(填化学式)。
(5)装置丁中的现象是_________________,说明_________________________。
【答案】(1)正极(1分) (2)2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4(2分) (3)1∶1(2分)
2Cu+O2↑+2H2SO4(2分) (3)1∶1(2分)
(4)银(2分) AgNO3(2分) (5)Y极附近红褐色变深(1分) 氢氧化铁胶粒带正电(2分)
【解析】由向乙中滴入酚酞试液,在F极附近显红色,说明F为阴极,那么E为阳极,所以B为电源的负极,A为电源的正极。甲是电解CuSO4溶液,总方程式:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4。乙装置中生成的气体为Cl2和H2,体积比为1∶1。丙是电镀池,所以给铜镀银,阳极G应为Ag,阴极H为Cu,电镀液为AgNO3溶液。由于氢氧化铁胶粒带正电,所以有外加电源时,胶粒定向移动,向阴极移动,所以Y极附近红褐色变深。
2Cu+O2↑+2H2SO4。乙装置中生成的气体为Cl2和H2,体积比为1∶1。丙是电镀池,所以给铜镀银,阳极G应为Ag,阴极H为Cu,电镀液为AgNO3溶液。由于氢氧化铁胶粒带正电,所以有外加电源时,胶粒定向移动,向阴极移动,所以Y极附近红褐色变深。


科目:高中化学 来源: 题型:
【题目】丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如下:

(1)H中含氧官能团的名称为_____、_____。
(2)D的系统命名是___________;J的结构简式为_____________。
(3)由A生成B的化学方程式为_______________________,反应类型__________。
(4)C与银氨溶液反应的化学方程式为_______________________________________。
(5)H在一定条件下生成高分子化合物的结构简式为_______________。
(6)G的同分异构体中核磁共振氢谱有4组峰,且能与FeCl3溶液发生显色反应,写出其中两种符合上述条件的同分异构体的结构简式_________________________。
(7)写出由物质A、甲醛、液溴为原料合成“2一苯基乙醇”的路线图:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同物质的溶液酸碱性不同,根据下表中pH的情况判断,下列说法中不正确的是( )
盐酸 | CuSO4溶液 | NaCl溶液 | 水 | Na2CO3溶液 | NaOH溶液 | |
pH | <7 | <7 | =7 | =7 | >7 | >7 |
A.酸溶液一定显酸性
B.显碱性的溶液不一定是碱溶液
C.盐溶液一定显中性
D.盐溶液不一定显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是制造光电池的一种原料,人体缺少硒就会得“克山病”,从电解精炼铜的阳极泥中提取硒的流程如下:
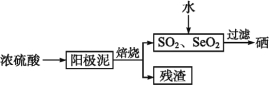
请回答下列问题:
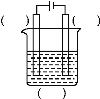
(1)实验室中电解精炼铜的简易装置如图所示,请在图中标出电极材料和电解液的名称。
(2)阳极泥中硒以Se、Ag2Se、Cu2Se等形式存在,Se与浓硫酸反应的化学方程式为 。
(3)SeO2溶于水得H2SeO3(Ka1=3.5×10-3,Ka2=5.0×10-8),亚硒酸溶液与SO2反应制硒的离子方程式为 。电解亚硒酸溶液可制得强酸H2SeO4,则电解时的阳极反应式为 。
(4)上述硒的提取过程中存在的主要问题是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,一定不能自发进行的是
A.2KClO3(s)![]() 2KCl (s)+3O2 (g) ΔH= 78. 03 kJ· mol1 ΔS=+1 110 J/(mol·K)
2KCl (s)+3O2 (g) ΔH= 78. 03 kJ· mol1 ΔS=+1 110 J/(mol·K)
B.CO(g)![]() C(石墨,s)+
C(石墨,s)+![]() O2(g) ΔH=+ 110. 5 kJ· mol1 ΔS=89.36 J/(mol·K)
O2(g) ΔH=+ 110. 5 kJ· mol1 ΔS=89.36 J/(mol·K)
C.4Fe(OH)2(s)+2H2O(l)+O2(g)![]() 4Fe(OH)3(s) ΔH=444.3 kJ·mol1 ΔS=280.1 J/(mol·K)
4Fe(OH)3(s) ΔH=444.3 kJ·mol1 ΔS=280.1 J/(mol·K)
D.NH4HCO3(s)+ CH3COOH(aq) ![]() CO2(g)+ CH3COONH4 (aq)+H2O(l) ΔH=+37.3 kJ·mol1 ΔS=+184.0 J/(mol·K)
CO2(g)+ CH3COONH4 (aq)+H2O(l) ΔH=+37.3 kJ·mol1 ΔS=+184.0 J/(mol·K)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境。某化学兴趣小组对废气A的组成进行探究,请回答下列问题。
(1)同学甲设计实验检验废气A中含有CO2,应选择的试剂有_________。
A.NaOH溶液 B.酸性KMnO4溶液 C.澄清石灰水 D.盐酸
(2)同学乙欲测定废气A中SO2的含量,取a L废气A并设计了如下装置进行实验。

①为了保证实验成功,装置A应具有的现象是___________,搅拌的目的是___________。
②同学丙认为A装置前后的质量差就是a L废气中含有的SO2的质量,然后进行含量计算。经小组讨论后,同学丁提出疑问,按照同学丙的实验,若废气中SO2完全被吸收,则最后测定的结果应该偏大,同学丁推断的理由是_______________________________。
(3)兴趣小组的同学查阅资料发现可利用硫酸工业废气A制备皓矾(ZnSO4·7H2O)。实验模拟制备皓矾工业流程如下:

①氧化中加入硫酸铁发生反应的离子方程式是____________________。
②加入Zn粉的目的是_________________________________。
③固体A主要成分是__________________。
④操作b得到纯净皓矾晶体,必要的操作是蒸发浓缩、__________、过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com