
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一元素。根据表中所列元素回答问题:

(1)元素B在周期表中的位置是______。
(2)上表短周期元素中金属性最强的是______(填元素符号)。
(3)最高价氧化物对应水化物酸性最强的物质______(填化学式)。
(4)A、C、D三元素形成化合物的电子式为______,该化合物中含有的作用力有______。
(5)表中F、G、H元素可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是______(用离子符号表示)。
(6)E可在B、C形成的常见化合物中燃烧的方程式是______。
【答案】第二周期第ⅣA族 Na HClO4 ![]() 离子键、(极性)共价键 S2->Cl->K+ 2Mg+CO2
离子键、(极性)共价键 S2->Cl->K+ 2Mg+CO2![]() 2MgO+C
2MgO+C
【解析】
由元素在周期表的位置可知:A为H、B为C、C为O、D为Na、E为Mg、F为S、G为Cl、H为K,I为Br,据此解答。
(1)B为C元素位于周期表第二周期第ⅣA族,故答案为:第二周期第ⅣA族;
(2)金属性强的元素位于周期表的左下位置,在短周期的已知元素中金属性最强的是Na,故答案为:Na;
(3)周期表已知的元素中非金属性强、并且有最高价含氧酸的元素为Cl,其最高价氧化物对应水化物为HClO4,故答案为:HClO4;
(4)NaOH是离子化合物,由钠离子和氢氧根离子构成,其中OH-中含有极性共价键,所以NaOH的电子式为![]() ,NaOH中含有的作用力为离子键和极性共价键,故答案为:
,NaOH中含有的作用力为离子键和极性共价键,故答案为:![]() ;离子键、共价键;
;离子键、共价键;
(5)S2-、Cl-、K+的核外电子排布相同,原子序数越小,离子半径越大,所以S2-、Cl-、K+的离子半径由大到小的顺序为S2->Cl->K+,故答案为:S2->Cl->K+;
(6)Mg是活泼金属,能与CO2反应生成碳和氧化镁,化学方程式为2Mg+CO2![]() 2MgO+C,故答案为:2Mg+CO2
2MgO+C,故答案为:2Mg+CO2![]() 2MgO+C。
2MgO+C。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】(1)有下列几种物质:
A. 金刚石和石墨 B. C2H6和C5H12 C. C2H4和C2H6 D. CH3CH2CH2CH3和CH3CH(CH3)2 E.35Cl 和37Cl
属于同分异构体的是(________),属于同素异形体的是(_________),属于同系物的是(__________),属于同位素的是(__________);
(2)铅蓄电池是目前机动车、船舶等不可缺少的动力能源,铅蓄电池在放电时发生的电池反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。则铅蓄电池的负极为________,正极为________。
(3)按要求完成下列问题:
①分子中的碳原子数小于或等于4的沸点最高的气态烷烃的结构简式____________;
②乙烷的分子式___________;
③苯与氢气反应的化学方程式 ___________;
④甲烷与氯气生成一氯甲烷的反应方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应A2(g)+2B2(g)=2AB2(g)(A2、B2、AB2的结构式分别为 A===A、B—B、B—A—B),能量变化如图所示,下列有关叙述中正确的是( )

A. 该反应的进行一定需要加热或点燃条件
B. 该反应若生成2molAB2(g)则放出的热量为 (E1-E2) kJ
C. 该反应断开化学键消耗的总能量大于形成化学键释放的总能量
D. 生成2 mol B—A键放出E2 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国煤炭资源丰富,通过煤的气化和液化。能使煤炭得以更广泛的应用。
I.先将煤转化为CO,再利用CO和水蒸气反应制取H2,反应为CO(g)+H2O(g)CO2(g)+H2(g)
(1)向2L恒容密闭容器中充入CO和水蒸气,800℃时测得部分数据:
t/min | 0 | 1 | 2 | 3 | 4 |
n(CO)/mol | 0.80 | 0.64 | 0.50 | 0.20 | 0.20 |
n(H2O)/mol | 1.20 | 1.04 | 0.90 | 0.60 | 0.60 |
从反应开始到2min时,υ(H2)为___________________;该温度下反应的平衡常数K=__________。
(2)相同条件下,向2L恒容密闭容器中充入1molCO、3mol水蒸气、2molCO2、2mol H2,此时υ正____υ逆(填“>”、“<”或“=”)。
II.利用CO生产燃料甲醇(CH3OH),一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g),图a表示反应中能量的变化,图b表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH的浓度随时间的变化:
CH3OH(g),图a表示反应中能量的变化,图b表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH的浓度随时间的变化:

(1)在图a中,曲线_____(填“a”或“b”)表示使用了催化剂;该反应属于_______反应(填“吸热”或“放热”);若保持其他条件不变,将反应体系升温,则该反应的平衡常数将______(填“变大”、“变小”或“不变”)。
(2)下列说法正确的是_______(填序号)。
① 起始充入的CO为2mol
② 增加CO浓度,CO的转化率增大
③ 当混合气体的密度不变时,反应达到平衡
④ 保持温度和容积不变,再充入2molCO和4mol H2,再次达平衡时![]() 会减小
会减小
(3)若在相同情况下,最初向容器中充入____mol CH3OH(g),可以达到上述同样的平衡状态。
(4)请在下图中画出平衡时甲醇的百分含量随压强的变化曲线,要求画温度不同的2条曲线(在曲线上标出T1、T2且T1&t;T2)。____________
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”,实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案,其中t3 <t2 <t1:
实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 (℃) | 溶液颜色褪至无色所需时间(s) | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | |||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 | t1 |
② | 0.20 | 2.0 | 0.01 | 4.0 | 25 | t2 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 | t3 |
请回答:
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,每消耗1molH2C2O4转移_______mol电子。当观察到紫色刚好褪去,参加反应的H2C2O4和KMnO4的物质的量之比为n(H2C2O4)∶n(KMnO4)=_________。
(2)实验①测得KMnO4溶液的褪色时间为t1=40s,忽略混合前后溶液体积的变化,这段时间内平均反应速率υ(KMnO4)=___________mol/(L·min)。
(3)根据表中的实验②和实验③数据,可以得到的结论是__________________________。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图a所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应当如图b所示:

该小组同学根据图b所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是__________________________________________。
②请你帮助该小组同学完成实验方案,并填写表中空白.
实验编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 (℃) | 向试管中加入少量固体 | 溶液颜色褪至无色所需时间(s) | ||
浓度(mol/L) | 体积(mL) | 浓度(mol/L) | 体积(mL) | ||||
④ | 0.20 | 2.0 | 0.01 | 4.0 | 50 | _____ | t4 |
③若该小组同学提出的假设成立,应观察到的现象是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电化学气敏传感器的工作原理如图所示,下列说法不正确的是

A. a极为负极
B. b极的电极反应式为O2+4e-+2H2O=4OH-
C. 电解质溶液中的OH- 移向a极
D. 该传感器工作一段时间后,电解质溶液的pH值将变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应:2A(g)![]() B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
实验 序号 | 时间/min 浓度/molL-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验1中,在10~20 min内,以物质A表示的平均反应速率为____mol·L-1·min-l,50 min时,v(正)____(填“<”“>”或“=”)v(逆)。
(2)0~20 min内,实验2比实验1的反应速率_____(填“快”或“慢”),其原因可能是______。
(3)实验3比实验1的反应速率____(填“快”或“慢”),其原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1HA溶液,滴定曲线如图。下列说法不正确的是
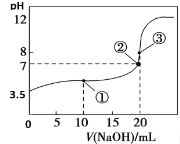
A. 常温下,HA电离常数为1.0×10-6
B. 点②所示溶液中:c(Na+)< c(HA)+c(A-)
C. 点③所示溶液中:c(Na+)> c(A-)> c(OH-)>c(H+)
D. 从点①到点③的滴定过程中,水的电离程度不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com