
【题目】我国煤炭资源丰富,通过煤的气化和液化。能使煤炭得以更广泛的应用。
I.先将煤转化为CO,再利用CO和水蒸气反应制取H2,反应为CO(g)+H2O(g)CO2(g)+H2(g)
(1)向2L恒容密闭容器中充入CO和水蒸气,800℃时测得部分数据:
t/min | 0 | 1 | 2 | 3 | 4 |
n(CO)/mol | 0.80 | 0.64 | 0.50 | 0.20 | 0.20 |
n(H2O)/mol | 1.20 | 1.04 | 0.90 | 0.60 | 0.60 |
从反应开始到2min时,υ(H2)为___________________;该温度下反应的平衡常数K=__________。
(2)相同条件下,向2L恒容密闭容器中充入1molCO、3mol水蒸气、2molCO2、2mol H2,此时υ正____υ逆(填“>”、“<”或“=”)。
II.利用CO生产燃料甲醇(CH3OH),一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g),图a表示反应中能量的变化,图b表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH的浓度随时间的变化:
CH3OH(g),图a表示反应中能量的变化,图b表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH的浓度随时间的变化:

(1)在图a中,曲线_____(填“a”或“b”)表示使用了催化剂;该反应属于_______反应(填“吸热”或“放热”);若保持其他条件不变,将反应体系升温,则该反应的平衡常数将______(填“变大”、“变小”或“不变”)。
(2)下列说法正确的是_______(填序号)。
① 起始充入的CO为2mol
② 增加CO浓度,CO的转化率增大
③ 当混合气体的密度不变时,反应达到平衡
④ 保持温度和容积不变,再充入2molCO和4mol H2,再次达平衡时![]() 会减小
会减小
(3)若在相同情况下,最初向容器中充入____mol CH3OH(g),可以达到上述同样的平衡状态。
(4)请在下图中画出平衡时甲醇的百分含量随压强的变化曲线,要求画温度不同的2条曲线(在曲线上标出T1、T2且T1&t;T2)。____________
 。
。
【答案】0.075mol/(L·min)3>a放热变小①④2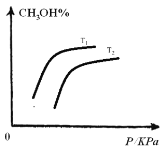
【解析】
Ⅰ.(1)根据表中数据可知,反应在2 min时CO的物质的量减少了0.80mol-0.50mol=0.30mol。根据方程式可知,氢气的物质的量应增加0.30mol,浓度增加0.30mol÷2L=0.15mol/L,所以2min内的平均速率为v(H2)=![]() =0.075 mol·L-1·min-1;由表中数据可知,反应在进行3min至4min时,CO与H2O的物质的量保持不变,说明此时反应处于平衡状态,则有如下关系:
=0.075 mol·L-1·min-1;由表中数据可知,反应在进行3min至4min时,CO与H2O的物质的量保持不变,说明此时反应处于平衡状态,则有如下关系:
CO(g)+H2O(g)![]() H2(g)+CO2(g)
H2(g)+CO2(g)
起始浓度(mol/L) 0.40 0.60 0 0
转化浓度(mol/L) 0.30 0.30 0.30 0.30
平衡浓度(mol/L) 0.10 0.30 0.30 0.30
所以平衡常数K=![]() =3.0,故答案为:0.075mol/(L·min)、3;
=3.0,故答案为:0.075mol/(L·min)、3;
(2)相同条件下,向2L恒容密闭容器中充入1molCO、3mol水蒸气、2molCO2、2mol H2,此时反应的浓度熵Qc=![]() =
=![]() <K,说明反应此时向正反应方向进行,则υ正>υ逆,故答案为:>;
<K,说明反应此时向正反应方向进行,则υ正>υ逆,故答案为:>;
II.(1)由图可知,曲线a降低了反应所需的活化能,则a使用了催化剂,又因该反应中反应物的总能量大于生成物的总能量,则该反应为放热反应;其他条件不变,将反应体系升温,平衡逆向移动,则该反应的平衡常数将减小,故答案为:a;放热;变小;
(2)① 由图可知起始CO的浓度为1mol/L,则CO的起始物质的量为1mol/L×2L=2mol;
②增加CO浓度,会促进氢气的转化,氢气的转化率增大,但CO的转化率减小;
③由于在反应过程中,反应混合物的总质量不变,容器的体积不变,则气体的密度并不随反应的时行而发生变化,故当混合气体的密度不变时,反应不一定达到平衡;
④保持温度和容积不变,再充入2molCO和4mol H2,与原平衡比较,相当于增大压强,平衡正向移动,再次达平衡时![]() 会减小;
会减小;
综上所述,正确的说法有①④,故答案为:①④;
(3)若在相同情况下,通过从逆反应方向开始建立上述同样的平衡状态,则须满足起始加入量“一边倒”之后与原平衡相同,原平衡的起始加入量为4molH2和2molCO,故需加入2mol CH3OH(g),故答案为:2;
(4)由于该反应正反应为气体体积缩小的可逆反应,增大压强,平衡正向移动,甲醇的含量增大;该反应正反应为放热反应,升高温度,甲醇的含量减小,由此分析可得图像为: ,故答案为:
,故答案为: 


科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按下图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

(1)下列说法中正确的是________(填序号)。
A 甲、乙均为化学能转变为电能的装置
B 乙中铜片上没有明显变化
C 甲中铜片质量减少、乙中锌片质量减少
D 两烧杯中H+的浓度均减小
(2)在相同时间内,两烧杯中产生气泡的速率:甲________(填“>”“<”或“=”)乙。
(3)甲烧杯中锌电极为 _________(正极/负极),写出铜极的电极方程式___________
(4)当甲中产生1.12 L(标准状况)气体时,理论上通过导线的电子数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,第(1)(2)小题用元素符号或化学式回答,(3)~(5)小题按题目要求回答。
族 周期 | I A | Ⅱ A | Ⅲ A | Ⅳ A | Ⅴ A | Ⅵ A | Ⅶ A | O |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)表中A~I元素中,化学性质最不活泼的是________,只有负价而无正价的是_________,氧化性最强的单质是_______,还原性最强的单质是____________。
(2)在B、C、E、F、G、H中,原子半径最大的是__________________。
(3)最高价氧化物的水化物碱性最强的化合物的电子式是___________。
(4)A和D组成最简单的化合物的电子式是_____________________。
(5)用电子式表示B和H组成化合物的形成过程_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸,制取出一种黄绿色气体。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ. 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下振荡,静置后CCl4层溶液变为紫红色。
(1)A中湿润的KI淀粉试纸变蓝,得出结论:________________________。
(2)B中溶液发生反应的离子方程式是________________________________。
(3)操作Ⅳ可得出结论:____________________________________________。
(4)实验结论:本实验中的卤素单质氧化性由强到弱依次为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2SO4是一种常见的化肥,某工厂用石膏、NH3、H2O和CO2制备(NH4)2SO4的工艺流程如下:

下列说法正确的是
A. 通入NH3和CO2的顺序可以互换
B. 操作2为将滤液加热浓缩、冷却结晶、过滤,可得(NH4)2SO4
C. 步骤②中反应的离子方程式为Ca2++2NH3+CO2+H2O=CaCO3↓+2NH4+
D. 通入的NH2和CO2均应过量,且工艺流程中CO2可循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用石墨电极电解MgCl2溶液:Mg2++2C1-+2H2O![]() Mg(OH)2↓+Cl2↑+H2↑
Mg(OH)2↓+Cl2↑+H2↑
B. 向明矾溶液中滴加碳酸钠溶液:2Al3++3CO32-==Al2(CO3)3↓
C. 向Ca(HCO3)2溶液中滴加少最NaOH溶液:Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O
D. 向Fe(NO3)3溶液中加入过量的HI溶液:2NO3-+8H++6I-==3I2+2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一元素。根据表中所列元素回答问题:

(1)元素B在周期表中的位置是______。
(2)上表短周期元素中金属性最强的是______(填元素符号)。
(3)最高价氧化物对应水化物酸性最强的物质______(填化学式)。
(4)A、C、D三元素形成化合物的电子式为______,该化合物中含有的作用力有______。
(5)表中F、G、H元素可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是______(用离子符号表示)。
(6)E可在B、C形成的常见化合物中燃烧的方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体X由四种元素组成,为探究其组成和性质,设计并完成如下实验:

(1)固体X中含有H、O、______和______元素。
(2)写出固体X受热分解的化学方程式______。
(3)取少量固体B溶于稀硫酸,加入适量的KI溶液,反应后溶液显棕黄色,同时产生一种白色的碘化物沉淀,写出产生该现象的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①写出乙炔的结构式________________;②写出水玻璃中溶质的化学式________________。
(2)写出二氧化锰与浓盐酸共热反应的化学方程式:___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com