
����Ŀ����֪A��B��C��D��E��F�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵĺ˵����A<B<C<D<E<F������Aԭ�ں���������δ�ɶԵ��ӣ�������B2EΪ���Ӿ��壬Eԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ�CԪ���ǵؿ��к�����ߵĽ���Ԫ�أ�D���ʵľ���������ͬ���ڵĵ�����û����ͬ�ģ�Fԭ��������������B����ͬ�����������������ӡ������������Ϣ���ش���������(����ʱ��A��B��C��D��E��F������Ӧ��Ԫ�ط��ű�ʾ)��
��1��A��B��C��D�ĵ�һ��������С�����˳��Ϊ_______________________________��
��2��B���Ȼ�����۵��D���Ȼ�����۵�________(����������������)��������___________��
��3��A���⻯������е�����ԭ�Ӳ�ȡ________�ӻ���E�ĵͼ���������ӵ����幹����______��
��4��F�ĺ�������Ų�ʽ��______________��F�ĸ�������A�ļ��⻯���γɵ������ӵĻ�ѧʽΪ________��
��5��A��F�γ�ij�ֻ�����ľ����ṹ��ͼ��ʾ(����A�ԣ�3��)�����仯ѧʽΪ________(ÿ�������ʾ1��ԭ��)��

��6��A��C�γɵĻ�������и߷е��Ӳ�ȣ���һ���������ǽ������ϣ����仯ѧʽΪ________���侧���������Ļ�ѧ������Ϊ________��
���𰸡� Na<Al<Si<N �� NaClΪ���Ӿ��壬��SiCl4Ϊ���Ӿ��� sp3 V�� 1s22s22p63s23p63d104s1(��[Ar]3d104s1) [Cu(NH3)4]2�� Cu3N AlN ���ۼ�
����������֪A��B��C��D��E��F�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵĺ˵����A<B<C<D<E<F��Eԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ���E��������B2EΪ���Ӿ��壬����B��Na������Aԭ�ں���������δ�ɶԵ�����Ϊ�ڶ�����VA��ĵ�Ԫ�أ����ǵؿ��к������Ľ���Ԫ�أ���CΪAl���ڵ������ڵ����γɵľ����й�ľ��������������ľ�����ͬ����DΪSi��Fԭ�ӵ�����������Ҳ��һ������Ϊ��������IA���IB��Ԫ�أ��������ڲ���ѳ������ӣ���Ϊͭ��
��1���ǽ�����Խǿ����һ������Խ�����A��B��C��D�ĵ�һ��������С�����˳��ΪNa<Al<Si<N����2������NaClΪ���Ӿ��壬��SiCl4Ϊ���Ӿ��壬����B���Ȼ�����۵��D���Ȼ�����۵������3��A���⻯������ǰ���������ԭ�Ӳ�ȡsp3�ӻ���E�ĵͼ������������SO2��Sԭ�ӵļ۲���Ӷ�����4������2�Թ¶Ե��ӣ������幹����V������4��ͭ��ԭ��������29����������Ų�ʽ��1s22s22p63s23p63d104s1(��[Ar]3d104s1)��ͭ�ĸ�������N�ļ��⻯�ﰱ���γɵ������ӵĻ�ѧʽΪ[Cu(NH3)4]2������5����ԭ�Ӱ뾶С��ͭԭ�Ӱ뾶��������N��������8��1/8=1��������ͭ��������12��1/4=3����˻�ѧʽΪCu3N����6��N��Al�γɵĻ�������и߷е��Ӳ�ȣ���һ���������ǽ������ϣ��������ԭ�Ӿ��壬���ݻ��ϼۿ�֪�仯ѧʽΪAlN���侧���������Ļ�ѧ������Ϊ���ۼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾʽ�������(����)
A. Na���Ĺ����ʾʽ��![]() B. Na���Ľṹʾ��ͼ��
B. Na���Ľṹʾ��ͼ��![]()
C. Na�ĵ����Ų�ʽ��1s22s22p63s1 D. Na����Χ�����Ų�ʽ��3s1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й��ȵ�˵������ȷ���ǣ� ��
A.����������仯ѧ�����������Ƶ�B.��������Ӣ����ѧ�Ҵ�ά������
C.��Ԫ����Ҫ�Ե��ʵ���ʽ�������ں�ˮ��D.������һ����Ҫ�Ļ���ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����йػ�ѧ����ı�����ȷ����( )
A. �ڻ�̬�����ԭ���У�p�����������һ������s�����������
B. ��̬Feԭ�ӵ���Χ�����Ų�ͼΪ![]()
C. ����Ԫ�ص縺�Աȵ�Ԫ�ش���ԭ�ӵ�һ�����ܱȵ�ԭ�ӵ�һ�����ܴ�
D. ����ԭ�Ӻ�������Ų����ص㣬Cu��Ԫ�����ڱ���λ��s��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�Ƽ������߶Ժ���̼���ʵĽ������ĸ�ʴ����Һ����ԵĹ�ϵ�������о�����25��ʱ�ó���ҺpHֵ�����ĸ�ʴӰ���ϵ��ͼ��ʾ,����˵����ȷ���ǣ� ��
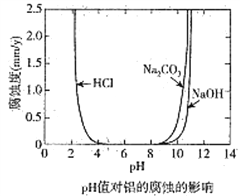
A. ��������Ũ�����еĸ�ʴ���ʴ��������еĸ�ʴ����
B. �����������Ի����в��ױ���ʴ
C. ��������pH=8.5��Na2CO3��Һ�лᷢ���绯ѧ��ʴ��������
D. �����õ��ķ����ڽ������ı����������ܵ������ﱡĤ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���������С�ظ���Ԫ(Ҳ�ƾ���)�����������壬�����������8�����Ǹ���һ����ԭ�ӣ��������������һ����ԭ�ӡ�����ÿ�������к���________����ԭ�ӡ�
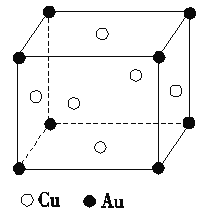
��2�����ͭ�����γɶ��ֽ������������һ�ֵľ���ṹ����ͼ��ʾ(Ϊ���������ṹ)���ý���������Ļ�ѧʽ________��
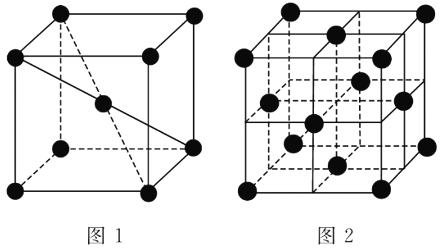
��3��1183 K���´�������Ļ����ṹ��Ԫ��ͼ1��ʾ��1 183 K����ת��Ϊͼ2��ʾ�ṹ�Ļ����ṹ��Ԫ�������־��������ڽ�����ԭ�ӵȾ������������ԭ����Ϊ________������1 183 K���ϵĴ��������У�����ԭ�ӵȾ������������ԭ����Ϊ________��
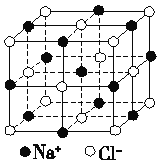
��4����ͼΪNaCl����ṹͼ��ͼ��ֱ�߽��㴦ΪNaCl������Na����Cl��������λ��(����������Ĵ�С)���Ӿ����п��Կ���Na����Χ�������ʱ�Ҿ�����ȵ�Na������________����
��5��ij���Ӿ��徧���ṹ��ͼ��ʾ��Xλ��������Ķ��㣬Yλ�����������ġ��Է�����
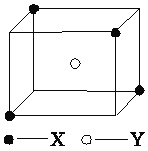
�پ�����ÿ��Yͬʱ������________��X��ÿ��Xͬʱ������________��Y��
�ھ�������ÿ��X��Χ������ӽ��Ҿ�����ȵ�X����________����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й��Ŵ��Ĵ���֮һ�����ڻ�ҩ�����ı�ը��ӦΪ2KNO3��3C��S![]() A��N2����3CO2��(����ƽ)
A��N2����3CO2��(����ƽ)
(1)��S�⣬����Ԫ�صĵ縺�ԴӴ�С����Ϊ________��
(2)���������У�A�ľ�������Ϊ________�������Թ��ۼ��ķ��ӵ�����ԭ�ӹ���ӻ�����Ϊ________��
(3)��֪CN����N2�ṹ���ƣ�����HCN�����ЦҼ���м���Ŀ֮��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Һ������������ԭ��Ӧ�����ܴ���������ǣ� ��
A.H����I����Br2��Na��
B.Ag����NO3����Cl����K��
C.K����Ba2����OH����SO42��
D.Cu2����NH4����Br����OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�д���5�����ӣ�NO3-��SO42-��Fe3+��H+��R���ӣ������ʵ���֮��Ϊ2��3��1��3��1����R����Ϊ
A. Ca2+ B. Mg2+ C. Cl- D. Ba2+
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com