
【题目】下列化学用语书写正确的是( )
A.甲烷的电子式:![]() B.丙烯的键线式:
B.丙烯的键线式:![]()
C.乙醚的结构式:![]() D.乙烯的结构简式:CH2CH2
D.乙烯的结构简式:CH2CH2
【答案】A
【解析】
A.甲烷分子中含有4个碳氢键,碳原子最外层达到8电子稳定结构;
B.键线式是进一步省去碳氢元素的符号,只表示分子中键的连接情况,键线式中每个拐点和终点均表示一个碳原子,每个碳原子都形成四个共价键,不足的用氢原子补足;
C.乙醚分子中含有2个乙基,不是两个甲基;
D.结构简式中需要标出官能团结构,乙烯的结构简式没有表示出其官能团碳碳双键。
A.甲烷分子中含有4个碳氢键,为正四面体结构,甲烷的电子式为:![]() ,选项A正确;
,选项A正确;
B.键线式中所有拐点和端点都有一个碳原子,![]() 为2—丁烯,丙烯有3个碳原子,丙烯的键线式为:
为2—丁烯,丙烯有3个碳原子,丙烯的键线式为:![]() ,选项B错误;
,选项B错误;
C.![]() 为甲醚的结构式,乙醚分子中含有两个乙基,不是两个甲基,选项C错误;
为甲醚的结构式,乙醚分子中含有两个乙基,不是两个甲基,选项C错误;
D.烯烃的结构简式中C=C双键不能省略,乙烯的结构简式为CH2=CH2,选项D错误;
答案选A。


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】一种从植物中提取的天然化合物a-damascone,可用于制作“香水”,其结构为:
 ,有关该化合物的下列说法不正确的是
,有关该化合物的下列说法不正确的是
A. 分子式为![]() B. 该化合物可发生聚合反应C. 1mol该化合物完全燃烧消耗19mol
B. 该化合物可发生聚合反应C. 1mol该化合物完全燃烧消耗19mol![]() D. 与溴的
D. 与溴的![]() 溶液反应生成的产物经水解、稀硝酸化后可用
溶液反应生成的产物经水解、稀硝酸化后可用![]() 溶液检验
溶液检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、![]() 、H3AsO4、H2O和一种未知物质X。
、H3AsO4、H2O和一种未知物质X。
(1)已知![]() 在反应中得到电子,则该反应的还原剂是______________。
在反应中得到电子,则该反应的还原剂是______________。
(2)已知0.2mol![]() 在反应中得到1mol电子生成X,则X的化学式为_____________。
在反应中得到1mol电子生成X,则X的化学式为_____________。
(3)根据上述反应可推知_________。
a.氧化性:![]() b.氧化性:
b.氧化性:![]()
c.还原性:![]() d.还原性:
d.还原性:![]()
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方
向和数目: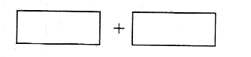 ___________。
___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A—O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。请回答下列问题:
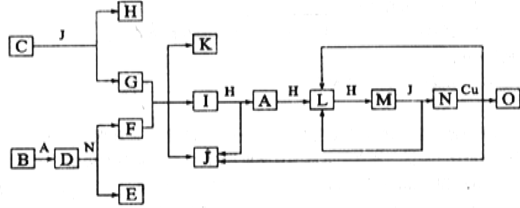
⑴组成B单质的元素位于周期表位置________________。化合物C电子式为____________。
⑵J的熔沸点比硒化氢(H2Se)的熔沸点高,其原因是_________________。
⑶I与H在一定条件下也可直接反应生成L和J, 写出化学方程式:_______________。
⑷写出D与水反应的化学方程式:_____________________。
⑸红棕色污染气体M的处理具有实际意义。现在常利用反应![]() (方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是_______L。
(方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷As是第四周期ⅤA族元素,可以形成 As2S3、As2O5、H3AsO3、H3AsO4等 化合物,有着广泛的用途回答下列问题:
(1)写出砷的原子序数______________
(2)工业上常将含砷废渣主要成分为As2S3制成浆状,通入O2氧化,生成H3AsO4和单质硫,写出发生反应的化学方程式___________;该反应需要在加压下进行,原因是___________.
(3)已知:As(s)+ ![]() H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+![]() O2(g)=H2O(l)△H2
O2(g)=H2O(l)△H2
2As(s)+![]() O2(g)=As2O5(s)△H3
O2(g)=As2O5(s)△H3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的△H =___________
(4)298K时,将20mL 3x molL-1 Na3AsO3、20mL 3x molL-1 I2和20mL NaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是 ______ 填标号.
a .溶液的pH不再变化 b. v(I-)=2v(AsO33-)
c .c (AsO43-)/c (AsO33-)不再变化 d. c(I-)=ymolL-1
②tm时v正_____v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v正(填“大于”“小于”或“等于”)理由是 _____
④若平衡时溶液c(OH-)=1 mol/L,则该反应的平衡常数K为 ______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度和压强下,30L某种气态纯净物中含有6.02×1023个分子,这些分子由1.204×1024个原子组成,下列有关说法中不正确的是
A.该温度和压强可能是标准状况
B.标准状况下该纯净物若为气态,其体积约是22.4L
C.该气体中每个分子含有2个原子
D.若O2在该条件下为气态,则1mol O2在该条件下的体积也为30L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为实验室制取乙酸乙酯的装置。

请回答:
(1)检验该装置气密性的方法是_________________________________。
(2)浓硫酸的作用是__________________。
(3)下列有关该实验的说法中,正确的是________。
A.向a试管中加入沸石,其作用是防止加热时液体爆沸
B.饱和碳酸钠溶液可以除去产物中混有的乙酸
C.乙酸乙酯是一种无色透明、密度比水大的油状液体
D.若原料为CH3COOH和CH3CH218OH,则乙酸乙酯中不含18O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室模拟工业上以预处理后的铬铁矿粉![]() 主要成分
主要成分![]() ,含少量
,含少量![]() 为原料制备
为原料制备![]() 并测定纯度,设计如下实验。回答下列问题:
并测定纯度,设计如下实验。回答下列问题:
Ⅰ![]() 煅烧铬铁矿粉。
煅烧铬铁矿粉。

已知:煅烧时,![]() 转化为
转化为![]() 。
。
(1)盛放![]() 的仪器名称为________装置B的作用为________。
的仪器名称为________装置B的作用为________。
(2)![]() 不能选用玻璃容器的原因为________。
不能选用玻璃容器的原因为________。
(3)实验时,a中所得产物除![]() 外还有一种红棕色固体,且观察到澄清石灰水变浑浊,则a中发生氧化还原反应的化学方程式为________。
外还有一种红棕色固体,且观察到澄清石灰水变浑浊,则a中发生氧化还原反应的化学方程式为________。
Ⅱ![]() 制备
制备![]() 。
。
(4)实验结束后,冷却至室温。取a中固体加水溶解,调节溶液的pH为![]() ;过滤,调节滤液的
;过滤,调节滤液的![]() ,蒸发浓缩、降温结晶,过滤、洗涤,得
,蒸发浓缩、降温结晶,过滤、洗涤,得![]() 粗品。
粗品。
①调节溶液的pH为![]() 后,第一次过滤,所得沉淀的成分为________
后,第一次过滤,所得沉淀的成分为________![]() 填化学式
填化学式![]() 。
。
②过滤所用主要玻璃仪器有________。
③结合离子方程式说明调节滤液的![]() 的目的为________。
的目的为________。
Ⅲ![]() 测定粗品中
测定粗品中![]() 的质量分数。
的质量分数。
(5)称取![]() 粗品,溶于适量水,酸化后配成100mL溶液;取
粗品,溶于适量水,酸化后配成100mL溶液;取![]() 所配溶液,滴加几滴指示剂,用
所配溶液,滴加几滴指示剂,用![]() 标准
标准![]() 溶液滴定至终点
溶液滴定至终点![]() 杂质不参加反应,还原产物为
杂质不参加反应,还原产物为![]() ,消耗标准液的体积为VmL。粗品中
,消耗标准液的体积为VmL。粗品中![]() 的质量分数为___
的质量分数为___![]() 用含c、m、V的代数式表示
用含c、m、V的代数式表示![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温,下列溶液中各浓度关系不正确的是
A. 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液pH>7,则一定有:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
B. 1L0.1molL-1CuSO4·(NH4)2SO46H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C. 0.1molL-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)≠c(HCO3-)+c(CO32-)+c(OH-)
D. 物质的量浓度分别为c1和c2的两种醋酸溶液,若其pH分别为a和a+1,则c1>10c2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com