
【题目】砷As是第四周期ⅤA族元素,可以形成 As2S3、As2O5、H3AsO3、H3AsO4等 化合物,有着广泛的用途回答下列问题:
(1)写出砷的原子序数______________
(2)工业上常将含砷废渣主要成分为As2S3制成浆状,通入O2氧化,生成H3AsO4和单质硫,写出发生反应的化学方程式___________;该反应需要在加压下进行,原因是___________.
(3)已知:As(s)+ ![]() H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+![]() O2(g)=H2O(l)△H2
O2(g)=H2O(l)△H2
2As(s)+![]() O2(g)=As2O5(s)△H3
O2(g)=As2O5(s)△H3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的△H =___________
(4)298K时,将20mL 3x molL-1 Na3AsO3、20mL 3x molL-1 I2和20mL NaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-AsO43-(aq)+2I-(aq)+H2O(l)。溶液中c(AsO43-)与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是 ______ 填标号.
a .溶液的pH不再变化 b. v(I-)=2v(AsO33-)
c .c (AsO43-)/c (AsO33-)不再变化 d. c(I-)=ymolL-1
②tm时v正_____v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v正(填“大于”“小于”或“等于”)理由是 _____
④若平衡时溶液c(OH-)=1 mol/L,则该反应的平衡常数K为 ______________
【答案】33 2As2S3 + 5O2 + 6H2O = 4H3AsO4 + 6S 加压能增大反应速率,而且平衡右移,可提高生产效率 2△H1-3△H2-△H3 a c 大于 小于 tm时生成物的浓度更小,故逆反应速率更慢 4y3/(x-y)2
【解析】
根据题意可知,本题考查化学方程式、热化学方程式的书写、化学平衡状态的判断,依据热化学方程式的书写步骤、化学平衡特征分析。
(1) 砷元素位于第四周期VA族,原子序数为33,
故答案为:33;
(2)工业上常将含砷废渣(主要成分为As2O3)制成浆状,通入O2氧化,生成H3AsO4和单质硫,砷元素化合价+3价变化为+5价,反应的化学方程式为2As2S3+5O2+6H2O=4H3AsO 4+6S,增大压强,可增加O2反应速率,提高As2S3的转化速率;
故答案为:2As2S3+5O2+6H2O=4H3AsO 4+6S;加压能增大反应速率,而且平衡右移,可提高生产效率;
(3)已知①As(s)+![]() H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+2O2(g)=H3AsO4(s)△H1
②H2(g)+![]() O2(g)=H2O(l) △H2
O2(g)=H2O(l) △H2
③2As(s)+![]() O2(g)=As2O5(s) △H3
O2(g)=As2O5(s) △H3
则利用盖斯定律将①×2-②×3-③可得As2O 5(s)+3H2O(l)=2H3AsO4(s) △H=2△H1-3△H2-△H3,
故答案为:2△H1-3△H2-△H3;
(4)①a.溶液pH不变时,则c(OH-)也保持不变,反应达到平衡状态,故a正确;
b.同一个化学反应,速率之比等于化学计量数之比,无论是否达到平衡,都存在v(I-)=2v(AsO33-),故b错误;
c.![]() 不再变化,可说明各物质的浓度不再变化,反应达到平衡状态,故c正确;
不再变化,可说明各物质的浓度不再变化,反应达到平衡状态,故c正确;
d.由图可知,当c(AsO43-)=2y mol/L时,浓度不再发生变化,则达到平衡状态,由方程式可知此时c(I-)=ymolL-1,所以c(I-)= ymolL-1时没有达到平衡状态,故d错误。
故答案为:ac;
②反应从正反应开始进行,tm时反应继续正向进行,则v正大于v逆,
故答案为:大于;
③tm时比tn时浓度更小,则逆反应速率更小;
故答案为:小于;tm时生成物的浓度更小,故逆反应速率更慢;
④反应前,三种溶液混合后,Na3AsO3的浓度为![]() ,同理I2的浓度为xmol/L,反应达到平衡时,生产c(AsO43-)为ymol/L,则反应生产的c(I-)=2ymol/L,消耗的AsO33-、I2的浓度均为ymol/L,平衡时c(AsO33-)=(x-y)mol/L,c(I2)=(x-y)mol/L,溶液中c(OH-)=1mol/L,则
,同理I2的浓度为xmol/L,反应达到平衡时,生产c(AsO43-)为ymol/L,则反应生产的c(I-)=2ymol/L,消耗的AsO33-、I2的浓度均为ymol/L,平衡时c(AsO33-)=(x-y)mol/L,c(I2)=(x-y)mol/L,溶液中c(OH-)=1mol/L,则![]() ,
,
故答案为:![]() 。
。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25 ℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D. 80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)①CaCO3(s)=CaO(s) + CO2(g) ΔH = + 177.7 kJ·mol-1
②C(s) + H2O(g)=CO(g) + H2(g) ΔH = -131.3 kJ·mol-1
③1/2H2SO4(l) + NaOH(l)=1/2Na2SO4(l) + H2O(l) ΔH = -57.3 kJ·mol-1
④C(s) + O2(g)=CO2(g) ΔH = -393.5 kJ·mol-1
⑤CO(g) + 1/2O2(g)=CO2(g) ΔH = -283 kJ·mol-1
(a)上述热化学方程式中表示不正确的有__(填序号)。
(b)根据上述信息,写出C转化为CO的热化学方程式__________。
(2)已知热化学方程式:H2(g)+1/2O2(g)=H2O(g)ΔH = -241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为__kJ·mol-1。
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) ΔH =﹣574 kJ·mol-1
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) ΔH =﹣1160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2生成N2,反应中转移的电子总数为__(用阿伏加德罗常数NA表示),放出的热量为__kJ。
(4)下列有关中和热的说法正确的是(________)
A.表示中和热的热化学方程式:H+(l)+OH-(l)=H2O(l) ΔH= -57.3 kJ·mol-1
B.准确测量中和热的实验过程中,至少需记录温度4次
C.中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,测量出的中和热数值偏小
D.已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1,则该反应的中和热为57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4能放出大量的热。
(1)已知:2NO2(g)=N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)=N2O4(g) 达到平衡。其它条件不变时,下列措施:
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
能提高NO2转化率的是_______(填字母)。
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O (l) ,放出19.14kJ
的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O (l)的△H=______kJ·mol-1。
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L-1、c(N2O4)=0.0120mol·L-1。计算反应2 NO2(g)![]() N2O4(g)的平衡常数K=______。
N2O4(g)的平衡常数K=______。
(4)现用一定量的Cu 与足量的浓HNO3反应,制得1.00L已达平衡的N2O4和NO2
混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu的质量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
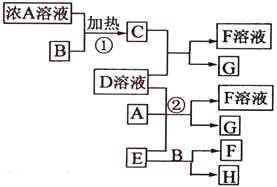
请回答下列问题:
(1)反应①的化学方程式为_____________________
(2)反应②的离子方程式为_____________________
(3)写出另外一种实验室制取H的化学方程式____________________________
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10—9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10—2mo1/L ,则生成沉淀所需Pb(NO3)2溶液的最小浓度为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为![]() 。A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如下图。关于A的下列说法中,正确的是( )
。A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如下图。关于A的下列说法中,正确的是( )

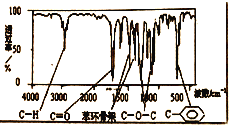
A.与A属于同类化合物的同分异构体只有2种
B.A在一定条件下可与4mol![]() 发生加成反应
发生加成反应
C.符合题中A分子结构特征的有机物只有1种
D.A分子属于酯类化合物,在一定条件下不能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在工业生产中有广泛的用途
Ⅰ![]() 实验室可用如下装置
实验室可用如下装置![]() 略去部分夹持仪器
略去部分夹持仪器![]() 制备亚硝酸钠。
制备亚硝酸钠。

已知:①![]() ;
;
②酸性条件下,NO和![]() 都能与
都能与![]() 反应生成
反应生成![]() 和
和![]() ;
;![]() 能使酸性高锰酸钾溶液褪色。
能使酸性高锰酸钾溶液褪色。
(1)加热装置A前,先通一段时间![]() ,目的是_______________________。
,目的是_______________________。
(2)装置A中发生反应的化学方程式为_______。酸性![]() 溶液的作用是_______。
溶液的作用是_______。
(3)仪器C的名称为______________,其中盛放的药品为 ____________![]() 填名称
填名称![]() 。
。
Ⅱ![]() 氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置。
氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如图所示的装置。

(1)已知甲装置试管中的固体是碳酸铵![]() 晶体。为了实现探究目的,乙装置中的固体是___________。乙装置的作用是__________________。
晶体。为了实现探究目的,乙装置中的固体是___________。乙装置的作用是__________________。
(2)写出受热时丙装置发生反应的化学方程式为________________。
(3)当戊中观察到____________________________现象,则说明已制得硝酸。某同学按上图组装仪器并检验气密性后进行实验,没有观察到此现象,请分析实验失败的可能原因:______________________。如何改进装置?_______。
(4)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,不正确的是
A.Na2CO3溶液显碱性:![]() +2H2O
+2H2O![]() H2CO3+2OH
H2CO3+2OH
B.HS电离的离子方程式:HS+H2O![]() H3O++S2
H3O++S2
C.少量氢氧化钙溶液与碳酸氢钠溶液混合,反应的离子方程式:Ca2++![]() +2OH
+2OH![]() CaCO3↓+2H2O+
CaCO3↓+2H2O+![]()
D.在0.5 mol·L1的K2Cr2O7溶液中存在如下平衡:![]() +H2O
+H2O![]() 2
2![]() +2H+,其平衡常数的表达式为
+2H+,其平衡常数的表达式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com