
����Ŀ��������A�����ϣ��������������֪����Է�������Ϊ136������ʽΪ![]() ��A�ĺ˴Ź���������4���������֮��Ϊ1��2��2��3��A������ֻ��һ�������ұ�����ֻ��һ��ȡ����������������˴Ź�����������ͼ������A������˵���У���ȷ���ǣ� ��
��A�ĺ˴Ź���������4���������֮��Ϊ1��2��2��3��A������ֻ��һ�������ұ�����ֻ��һ��ȡ����������������˴Ź�����������ͼ������A������˵���У���ȷ���ǣ� ��

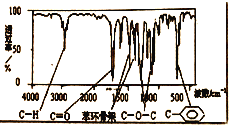
A.��A����ͬ������ͬ���칹��ֻ��2��
B.A��һ�������¿���4mol![]() �����ӳɷ�Ӧ
�����ӳɷ�Ӧ
C.��������A���ӽṹ�������л���ֻ��1��
D.A����������������һ�������²��ܷ���ˮ�ⷴӦ
���𰸡�C
��������
�л���A�ķ���ʽΪC8H8O2�������Ͷ�Ϊ5��A������ֻ��һ�������ұ�����ֻ��һ��ȡ������A�ĺ˴Ź���������4���������֮��Ϊ1:2:2:3��˵��A����������ԭ������ԭ�Ӹ���֮��Ϊ1:2:2:3����Ϻ������֪�������д��������Ȼ��ţ����л���A�Ľṹ��ʽΪ![]() ���ݴ˷�����
���ݴ˷�����
�л���A�ķ���ʽΪC8H8O2�������Ͷ�Ϊ5��A������ֻ��һ�������ұ�����ֻ��һ��ȡ������A�ĺ˴Ź���������4���������֮��Ϊ1:2:2:3��˵��A����������ԭ������ԭ�Ӹ���֮��Ϊ1:2:2:3����Ϻ������֪�������д��������Ȼ��ţ����л���A�Ľṹ��ʽΪ![]() ��
��
A. ����ͬ����Ӧ������������������Ϊ�����봼�γɵ����У����ᱽ��������Ϊ��������γɵ�������������������������Ǽ�������γɵ����������ڡ��䡢������λ�ã���5���칹�壬A�����
B. ֻ�б������������������ӳɷ�Ӧ����A��һ�������¿���3mol H2�����ӳɷ�Ӧ��B�����
C. ��������A���ӽṹ�������л���ֻ��1�֣�C����ȷ
D. A����������������������һ���������ܷ���ˮ�ⷴӦ��D�����
��ѡC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ʱ��0.1mo1/LijһԪ��HA��ˮ����0.1���������룬��������������ǣ�
A. ����Һ��pH=4 B. �����¶ȣ���Һ��pH���� C. ����ĵ���ƽ�ⳣ��ԼΪ1��10-7 D. ��HA�������c(H+)ԼΪˮ�������c(H+)��106��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2(g)+O2(g)![]() 2SO3(g)��Ӧ�����е������仯��ͼ��ʾ��ͼ��E1��ʾ����ʱ����Ӧ�Ļ�ܣ�E2��ʾ����ʱ�淴Ӧ�Ļ�ܣ��������й���������ȷ����
2SO3(g)��Ӧ�����е������仯��ͼ��ʾ��ͼ��E1��ʾ����ʱ����Ӧ�Ļ�ܣ�E2��ʾ����ʱ�淴Ӧ�Ļ�ܣ��������й���������ȷ����

A. �÷�Ӧ���淴ӦΪ���ȷ�Ӧ�������¶ȿ������ӵİٷ���
B. 500�桢101kPa�£���1molSO2(g)��0.5molO2(g)�����ܱ������г�ַ�Ӧ����SO3(g)����akJ�����Ȼ�ѧ����ʽΪ2SO2(g)+O2(g)![]() 2SO3(g) ��H=-2a kJ��mol-l
2SO3(g) ��H=-2a kJ��mol-l
C. �÷�Ӧ�У���Ӧ����ܼ���С����������ܼ���
D. ��H=E1-E2��ʹ�ô����ı��ܣ������ı䷴Ӧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����As�ǵ������ڢ�A��Ԫ�أ������γ� As2S3��As2O5��H3AsO3��H3AsO4�� ��������Ź㷺����;�ش��������⣺
��1��д�����ԭ������______________
��2����ҵ�ϳ������������Ҫ�ɷ�ΪAs2S3�Ƴɽ�״��ͨ��O2����������H3AsO4�͵�����,д��������Ӧ�Ļ�ѧ����ʽ___________;�÷�Ӧ��Ҫ�ڼ�ѹ�½��У�ԭ����___________.
��3����֪��As��s��+ ![]() H2��g��+2O2��g��=H3AsO4��s����H1
H2��g��+2O2��g��=H3AsO4��s����H1
H2��g��+![]() O2��g��=H2O��l����H2
O2��g��=H2O��l����H2
2As��s��+![]() O2��g��=As2O5��s����H3
O2��g��=As2O5��s����H3
��ӦAs2O5��s��+3H2O��l��=2H3AsO4��s���ġ�H =___________
��4��298Kʱ����20mL 3x molL-1 Na3AsO3��20mL 3x molL-1 I2��20mL NaOH��Һ��ϣ�������Ӧ��AsO33-��aq��+I2��aq��+2OH-AsO43-��aq��+2I-��aq��+H2O��l������Һ��c��AsO43-���뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ��

�����п��жϷ�Ӧ�ﵽƽ����� ______ ���ţ�
a .��Һ��pH���ٱ仯 b. v��I-��=2v��AsO33-��
c .c ��AsO43-��/c ��AsO33-�����ٱ仯 d. c��I-��=ymolL-1
��tmʱv��_____v��������ڡ���С�ڡ����ڡ�����
��tmʱv��_____ tnʱv��������ڡ���С�ڡ����ڡ��������� _____
����ƽ��ʱ��Һc(OH-)=1 mol/L����÷�Ӧ��ƽ�ⳣ��KΪ ______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��PCMX��һ�ְ�ȫ����Ч�����ķ�ùɱ�������ѹ㷺Ӧ���ں�Ƥ���Ӵ��ĸ��˻�����Ʒ��ϴ��Һ��������ȥм�㲨�Ȳ�Ʒ�У���ɱ���²�������ŧ���²��������²��Խ�ĸ���ȡ�����ӽṹ��ͼ��ʾ������PCMX����������ȷ���ǣ� ��
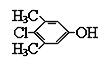
A.���������ڷ������ʣ�������ˮ
B.�������ڳ���������ɫ���壬����ʽΪC8H6ClO
C.�����ʲ��ܳ��ڸ�Ƥ���Ӵ����������Ϻ�Ӧ����ϴ��
D.�����£�1mol������������NaOH��Һ��ȫ��Ӧ����NaOH 2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ������ȡ����������װ�á�

��ش�
��1�������װ�������Եķ�����_________________________________��
��2��Ũ�����������__________________��
��3�������йظ�ʵ���˵���У���ȷ����________��
A����a�Թ��м����ʯ���������Ƿ�ֹ����ʱҺ�屬��
B������̼������Һ���Գ�ȥ�����л��е�����
C������������һ����ɫ�����ܶȱ�ˮ�����״Һ��
D����ԭ��ΪCH3COOH��CH3CH218OH�������������в���18O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ����PCl5���ȼ��ӷ��������ֽ⣺PCl5(g)![]() PCl3(g)��Cl2(g)���ֽ�5.84 g PCl5װ��2.05 L����ܱ������У���277 ��ﵽƽ�⣬������ѹǿΪ1.01��105Pa���������֪ƽ��ʱ�����ڻ����������ʵ���Ϊ0.05 mol����ƽ��ʱPCl5�ķֽ���__________��
PCl3(g)��Cl2(g)���ֽ�5.84 g PCl5װ��2.05 L����ܱ������У���277 ��ﵽƽ�⣬������ѹǿΪ1.01��105Pa���������֪ƽ��ʱ�����ڻ����������ʵ���Ϊ0.05 mol����ƽ��ʱPCl5�ķֽ���__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������![]() ��
��![]() ������Һ��ѡ����գ�
������Һ��ѡ����գ�
A. ![]()
��1��������pH��ͬʱ�������ʵ���Ũ��______��
��2�������ǵ����ʵ���Ũ����ͬʱ����pH�Ĺ�ϵ��______��
��3���к͵�����������ʵ���Ũ�ȵ��ռ���Һ����ͬ���ʵ���Ũ�ȵ���������Һ�������ϵΪ______��
��4����������ʵ���Ũ����ͬ��![]() ��
��![]() ����Һ���ֱ���ͬŨ�ȵ��ռ���Һ��Ӧ��Ҫʹ��Ӧ�����Һ�����ԣ������ռ���Һ�������ϵΪ______��
����Һ���ֱ���ͬŨ�ȵ��ռ���Һ��Ӧ��Ҫʹ��Ӧ�����Һ�����ԣ������ռ���Һ�������ϵΪ______��
��5��������pH��ͬ�������ͬʱ���ֱ��������п����ͬ״���²������������ϵΪ______��
��6����pH��ͬ���������ϡ��10����pH��ϵΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��298 K�����£�2mol����ȼ������ˮ�����ų�484 kJ�����������Ȼ�ѧ����ʽ��ȷ����( )��
A.2H2(g) + O2(g) = 2H2O(1) ��H = - 484 kJ��mol-1
B.H2O(g) = H2(g) + ![]() O2(g) ��H = + 242 kJ��mol-1
O2(g) ��H = + 242 kJ��mol-1
C.H2(g) + ![]() O2(g) = H2O(g) ��H = + 242 kJ��mol-1
O2(g) = H2O(g) ��H = + 242 kJ��mol-1
D.2H2(g) + O2(g) = 2H2O(g) ��H = + 484 kJ��mol-1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com