
【题目】PCMX是一种安全、高效、广谱的防霉杀菌剂,已广泛应用于和皮肤接触的个人护理产品如洗手液、肥皂、去屑香波等产品中,可杀灭肠道致病菌、化脓性致病菌、和致病性酵母菌等。其分子结构如图所示,对于PCMX的描述中正确的是( )
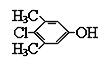
A.该物质属于酚类物质,易溶于水
B.该物质在常温下是无色晶体,分子式为C8H6ClO
C.该物质不能长期跟皮肤接触,擦在手上后应立即洗净
D.常温下,1mol该物质与足量NaOH溶液完全反应消耗NaOH 2mol
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
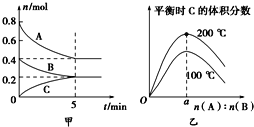
A. 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃时,该反应的平衡常数为25
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性小组借助A-D的仪器装置完成有关实验。

(实验一)收集NO气体。
(1)用装置A收集NO气体,正确的操作是________(填序号)。
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
c.从②口进气,用排水法集气 d.从②口进气,用排气法集气
(实验二)为了探究镀锌薄铁板上的锌的质量分数ω(Zn)和镀层厚度,查询得知锌易溶于强碱:Zn+2NaOH=Na2ZnO2+H2↑。据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究目标。
(2)选用B和________(填仪器标号)两个装置进行实验。
(3)测得充分反应后生成氢气的体积为VL(标准状况),ω(Zn)=________。
(4)计算镀层厚度,还需要检索的一个物理量是________。
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将________(填“偏大”、“偏小”或“无影响”)。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g。
(6)ω(Zn)=____________。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂总质量(其差值即为H2的质量)实现探究目标。实验同样使用仪器C。
(7)从实验误差角度分析,方案丙________方案乙(填“优于”、“劣于”或“等同于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H。
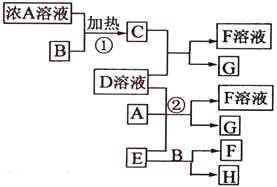
请回答下列问题:
(1)反应①的化学方程式为_____________________
(2)反应②的离子方程式为_____________________
(3)写出另外一种实验室制取H的化学方程式____________________________
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10—9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10—2mo1/L ,则生成沉淀所需Pb(NO3)2溶液的最小浓度为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应mA(g)+nB(g) ![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)若加入B(容器体积不变),则A的转化率______(填增大、减小或不变,下同),B的转化率______。
(2)若升高温度,则平衡时B、C的浓度之比c(B)/c(C)将______(填增大、减小或不变)。
(3)若B是有色物质,A、C均无色,则加入C(容积不变)时混合物颜色________(填变深、变浅或不变,下同),而维持容器内压强不变,充入Ne时,混合物的颜色_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为![]() 。A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如下图。关于A的下列说法中,正确的是( )
。A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如下图。关于A的下列说法中,正确的是( )

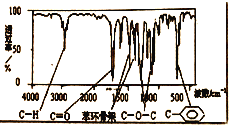
A.与A属于同类化合物的同分异构体只有2种
B.A在一定条件下可与4mol![]() 发生加成反应
发生加成反应
C.符合题中A分子结构特征的有机物只有1种
D.A分子属于酯类化合物,在一定条件下不能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;Ⅳ、Ⅴ、Ⅵ是气体收集装置,根据要求回答下列问题:



![]()


(1)若用MnO2与浓盐酸反应制取氯气,应选用装置________,用方程式表示的制取氯气的反应原理是___________________________。
(2)若用KMnO4与浓盐酸反应制取氯气,应选用的装置________,
试完成并配平下列离子方程式:___MnO4-+____Cl-+____H+![]() ___Mn2++___Cl2↑+_____。
___Mn2++___Cl2↑+_____。
(3)若选用Ⅳ为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用________溶液浸湿,其作用是________。
(4)若选用Ⅴ为氯气收集装置,则氯气应从________口通入.用化学方法检验氯气收集满了的方法是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用 0.1000 mol·L![]() NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L![]()
![]() 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是

A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.点③所示溶液中:![]()
D.滴定过程中可能出现:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化剂H2O2在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。
I.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下表所示的方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
(1)实验①和②的目的是_________________________________。同学们进行实验时没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进方法是_________________________(填一种方法即可)。
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图所示。
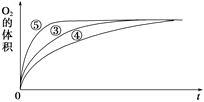
分析该图能够得出的实验结论是________________________________。
II.资料显示,某些金属离子或金属氧化物对H2O2的分解起催化作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如下图所示的实验装置进行实验。
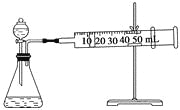
(1)某同学通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量_______或______来比较。
(2)0.1 g MnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。请解释化学反应速率变化的原因:_____________。请计算H2O2的初始物质的量浓度为________________(保留两位有效数字)。
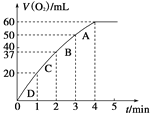
为探究MnO2在此实验中对H2O2的分解起催化作用,需补做下列实验(无 需写出具体操作):/span>a._________________;b.___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com