
ЁОЬтФПЁПФГЗДгІжаЗДгІЮягыЩњГЩЮягаЃКAsH3ЁЂH2SO4ЁЂ![]() ЁЂH3AsO4ЁЂH2OКЭвЛжжЮДжЊЮяжЪXЁЃ
ЁЂH3AsO4ЁЂH2OКЭвЛжжЮДжЊЮяжЪXЁЃ
ЃЈ1ЃЉвбжЊ![]() дкЗДгІжаЕУЕНЕчзгЃЌдђИУЗДгІЕФЛЙдМСЪЧ______________ЁЃ
дкЗДгІжаЕУЕНЕчзгЃЌдђИУЗДгІЕФЛЙдМСЪЧ______________ЁЃ
ЃЈ2ЃЉвбжЊ0.2mol![]() дкЗДгІжаЕУЕН1molЕчзгЩњГЩXЃЌдђXЕФЛЏбЇЪНЮЊ_____________ЁЃ
дкЗДгІжаЕУЕН1molЕчзгЩњГЩXЃЌдђXЕФЛЏбЇЪНЮЊ_____________ЁЃ
ЃЈ3ЃЉИљОнЩЯЪіЗДгІПЩЭЦжЊ_________ЁЃ
aЃЎбѕЛЏадЃК![]() bЃЎбѕЛЏадЃК
bЃЎбѕЛЏадЃК![]()
cЃЎЛЙдадЃК![]() dЃЎЛЙдадЃК
dЃЎЛЙдадЃК![]()
ЃЈ4ЃЉНЋбѕЛЏМСКЭЛЙдМСЕФЛЏбЇЪНМАЦфХфЦНКѓЕФЯЕЪ§ЬюШыЯТСаЗНПђжаЃЌВЂБъГіЕчзгзЊвЦЕФЗН
ЯђКЭЪ§ФПЃК ___________ЁЃ
___________ЁЃ
ЁОД№АИЁПAsH3 Br2 ac ![]()
ЁОНтЮіЁП
гЩЬтжааХЯЂПЩжЊЃЌKBrO3дкЗДгІжаЕУЕНЕчзгЃЌдђЦфЮЊбѕЛЏМСЃЌAsH3ЪЧЛЙдМСЁЃИљОнбѕЛЏЛЙдЗДгІЕФЙцТЩНјааЯрЙиХаЖЯЁЃ
ЃЈ1ЃЉKBrO3дкЗДгІжаЕУЕНЕчзгЃЌдђСэЭтвЛжжЛЏКЯМлБфЛЏЕФдЊЫидкЗДгІжаЪЇШЅЕчзгБЛбѕЛЏЃЌЫљИјЮяжЪжаAsдЊЫиЛЏКЯМлЗЂЩњСЫБфЛЏЃЌЕЭМлЬЌЕФAsH3ЪЧЛЙдМСЃЌ![]() ЪЧбѕЛЏВњЮяЁЃ
ЪЧбѕЛЏВњЮяЁЃ
ЃЈ2ЃЉ0.2mol KBrO3ЕУЕН1molЕчзгЃЌЫЕУї+5МлЕФBrдЊЫидкЗДгІжаНЕЕЭСЫ5МлЃЌЫљвдxЕФЛЏбЇЪНЮЊBr2ЃЌЧвЦфЮЊЛЙдВњЮяЁЃ
ЃЈ3ЃЉбѕЛЏМСЕФбѕЛЏадДѓгкбѕЛЏВњЮяЕФбѕЛЏадЃЌЛЙдМСЕФЛЙдадДѓгкЛЙдВњЮяЕФЛЙдадЁЃ
aЃЎбѕЛЏадЃК![]() ЃЌaе§ШЗЃЛ
ЃЌaе§ШЗЃЛ
bЃЎбѕЛЏадЃК![]() ЃЌbДэЮѓЃЛ
ЃЌbДэЮѓЃЛ
cЃЎЛЙдадЃК![]() ЃЌcе§ШЗЃЛ
ЃЌcе§ШЗЃЛ
dЃЎЛЙдадЃК![]() ЃЌdДэЮѓЁЃ
ЃЌdДэЮѓЁЃ
ЙЪбЁac.
ЃЈ4ЃЉРћгУбѕЛЏЛЙдЗДгІжаЕчзгЕУЪЇЯрЕШЕФЙцТЩПЩХфЦНИУЗНГЬЪНЮЊЃК8KBrO3ЃЋ5AsH3ЃЋ4H2SO4===4K2SO4ЃЋ4Br2ЃЋ5H3AsO4ЃЋ4H2OЃЌЙЪЕчзгзЊвЦЕФЗНЯђКЭЪ§ФППЩБэЪОЮЊЃК![]() ЁЃ
ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПNaClO2ЕФЦЏАзФмСІЪЧЦЏАзЗлЕФ4ЁЋ5БЖЃЌ NaClO2ЙуЗКгУгкдьжНЙЄвЕЁЂЮлЫЎДІРэЕШЁЃЙЄвЕЩЯЩњВњNaClO2ЕФЙЄвеСїГЬШчЯТЃК
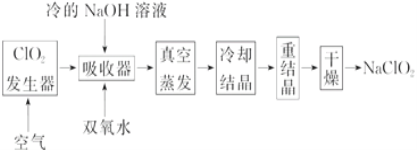
(1)ClO2ЗЂЩњЦїжаЕФЗДгІЮЊЃК2NaClO3ЃЋSO2ЃЋH2SO4===2ClO2ЃЋ2NaHSO4ЁЃЪЕМЪЙЄвЕЩњВњжаЃЌПЩгУСђЛЦЁЂХЈСђЫсДњЬцдСЯжаЕФSO2ЃЌЦфдвђЮЊ_____________(гУЛЏбЇЗНГЬЪНБэЪО)ЁЃ
(2)ЗДгІНсЪјКѓЃЌЯђClO2ЗЂЩњЦїжаЭЈШывЛЖЈСППеЦјЕФФПЕФЃК________________________ЁЃ
(3)ЮќЪеЦїжаЩњГЩNaClO2ЕФРызгЗДгІЗНГЬЪНЮЊ___________________________________ЁЃ
(4)ФГЛЏбЇаЫШЄаЁзщгУШчЯТЭМЫљЪОзАжУжЦБИSO2ВЂЬНОПSO2гыNa2O2ЕФЗДгІЃК
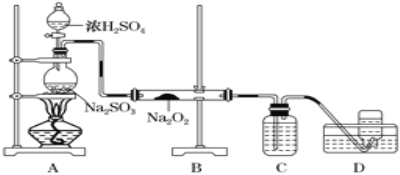
ЂйЪЂЗХХЈH2SO4вЧЦїУћГЦЮЊ_____ЃЌCжаШмвКЕФзїгУЪЧ____________ЁЃ
ЂкDжаЪеМЏЕНЕФЦјЬхПЩЪЙДјгрН§ЕФФОЬѕИДШМЃЌBжаЗЂЩњЕФЗДгІПЩФмЮЊ__________ЁЂNa2O2ЃЋSO2=Na2SO4ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЮТЖШЯТЃЌНЋ1 molЦјЬхAКЭ1 molЦјЬхBГфШы2 LФГУмБеШнЦїжаЃЌЗЂЩњЗДгІЃК![]() ЃЌ
ЃЌ![]() ЪБДяЕНЦНКтЁЃдк
ЪБДяЕНЦНКтЁЃдк![]() ЁЂ
ЁЂ![]() ЪБПЬЗжБ№ИФБфЗДгІЕФвЛИіЬѕМўЃЌВтЕУШнЦїжаЦјЬхCЕФХЈЖШЫцЪБМфБфЛЏЕФЧњЯпШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
ЪБПЬЗжБ№ИФБфЗДгІЕФвЛИіЬѕМўЃЌВтЕУШнЦїжаЦјЬхCЕФХЈЖШЫцЪБМфБфЛЏЕФЧњЯпШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.![]() ЪБИФБфЕФЬѕМўЪЧЪЙгУДпЛЏМС
ЪБИФБфЕФЬѕМўЪЧЪЙгУДпЛЏМС
B.ЗДгІЕФЛЏбЇЗНГЬЪНжаЃЌ![]()
C.![]() МфИУЗДгІЕФЦНКтГЃЪ§ОљЮЊ5
МфИУЗДгІЕФЦНКтГЃЪ§ОљЮЊ5
D.![]() ЪБИФБфЕФЬѕМўЪЧвЦШЅЩйСПЮяжЪD
ЪБИФБфЕФЬѕМўЪЧвЦШЅЩйСПЮяжЪD
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаЙиЯТСаЫФИіГЃгУЕчЛЏбЇзАжУЕФа№Ъіжае§ШЗЕФЪЧ( )

AЃЎЭМЂёЫљЪОЕчГижаЃЌИКМЋЕчМЋЗДгІЮЊZn-2e-![]() Zn2+
Zn2+
BЃЎЭМЂђЫљЪОЕчГиЗХЕчЙ§ГЬжаЃЌСђЫсХЈЖШВЛЖЯдіДѓ
CЃЎЭМЂѓЫљЪОзАжУЙЄзїЙ§ГЬжаЃЌЕчНтжЪШмвКжаCu2+ХЈЖШЪМжеВЛБф
DЃЎЭМЂєЫљЪОЕчГижаЃЌAg2OЪЧбѕЛЏМСЃЌЕчГиЙЄзїЙ§ГЬжаБЛЛЙдЮЊAg
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉЂйCaCO3(s)ЃНCaO(s) + CO2(g) ІЄH = + 177.7 kJЁЄmol-1
ЂкC(s) + H2O(g)ЃНCO(g) + H2(g) ІЄH = -131.3 kJЁЄmol-1
Ђл1/2H2SO4(l) + NaOH(l)ЃН1/2Na2SO4(l) + H2O(l) ІЄH = -57.3 kJЁЄmol-1
ЂмC(s) + O2(g)ЃНCO2(g) ІЄH = -393.5 kJЁЄmol-1
ЂнCO(g) + 1/2O2(g)ЃНCO2(g) ІЄH = -283 kJЁЄmol-1
ЃЈaЃЉЩЯЪіШШЛЏбЇЗНГЬЪНжаБэЪОВЛе§ШЗЕФга__ЃЈЬюађКХЃЉЁЃ
ЃЈbЃЉИљОнЩЯЪіаХЯЂЃЌаДГіCзЊЛЏЮЊCOЕФШШЛЏбЇЗНГЬЪН__________ЁЃ
ЃЈ2ЃЉвбжЊШШЛЏбЇЗНГЬЪНЃКH2(g)+1/2O2(g)ЃНH2O(g)ІЄH = -241.8 kJЁЄmol-1ЃЌИУЗДгІЕФЛюЛЏФмЮЊ167.2 kJЁЄmol-1ЃЌдђЦфФцЗДгІЕФЛюЛЏФмЮЊ__kJЁЄmol-1ЁЃ
ЃЈ3ЃЉгУCH4ДпЛЏЛЙдNOxПЩвдЯћГ§ЕЊбѕЛЏЮяЕФЮлШОЁЃР§ШчЃК
CH4(g)+ 4NO2(g)ЃН4NO(g)+ CO2(g)+ 2H2O(g) ІЄH =Љ574 kJЁЄmol-1
CH4(g)+ 4NO(g)ЃН2N2(g)+ CO2(g)+ 2H2O(g) ІЄH =Љ1160 kJЁЄmol-1
ШєгУБъзМзДПіЯТ4.48 L CH4ЛЙдNO2ЩњГЩN2ЃЌЗДгІжазЊвЦЕФЕчзгзмЪ§ЮЊ__ЃЈгУАЂЗќМгЕТТоГЃЪ§NAБэЪОЃЉЃЌЗХГіЕФШШСПЮЊ__kJЁЃ
ЃЈ4ЃЉЯТСагаЙижаКЭШШЕФЫЕЗЈе§ШЗЕФЪЧЃЈ________ЃЉ
AЃЎБэЪОжаКЭШШЕФШШЛЏбЇЗНГЬЪНЃКHЃЋ(l)ЃЋOHЃ(l)ЃНH2O(l) ІЄHЃН -57.3 kJЁЄmolЃ1
BЃЎзМШЗВтСПжаКЭШШЕФЪЕбщЙ§ГЬжаЃЌжСЩйашМЧТМЮТЖШ4ДЮ
CЃЎжаКЭШШЕФЪЕбщЙ§ГЬжаЃЌЛЗаЮВЃСЇНСАшАєВФСЯШєгУЭДњЬцЃЌВтСПГіЕФжаКЭШШЪ§жЕЦЋаЁ
DЃЎвбжЊ2NaOH(aq)ЃЋH2SO4(aq)ЃНNa2SO4(aq)ЃЋ2H2O(l) ІЄHЃН-114.6 kJЁЄmolЃ1ЃЌдђИУЗДгІЕФжаКЭШШЮЊ57.3 kJЁЄmolЃ1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯђФГУмБеШнЦїжаМгШы 0.3 mol AЁЂ0.1 mol C КЭвЛЖЈСПЕФ B Ш§жжЦјЬхЃЌ вЛЖЈЬѕМўЯТЗЂЩњШчЯТЗДгІЃК 3A(g) ![]() B(g)ЃЋ2C(g)ЃЌИїЮяжЪЕФХЈЖШЫцЪБМфБфЛЏШчЭМЫљЪО[t0ЁЋt1 НзЖЮЕФ c(B)БфЛЏЮДЛГі]ЁЃЯТСаЫЕЗЈжае§ШЗЕФЪЧ( )
B(g)ЃЋ2C(g)ЃЌИїЮяжЪЕФХЈЖШЫцЪБМфБфЛЏШчЭМЫљЪО[t0ЁЋt1 НзЖЮЕФ c(B)БфЛЏЮДЛГі]ЁЃЯТСаЫЕЗЈжае§ШЗЕФЪЧ( )
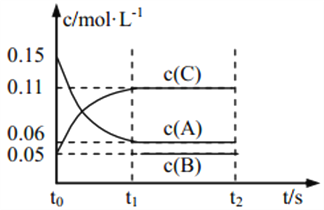
A. Шє t1ЃН15 sЃЌдђгУ A ЕФХЈЖШБфЛЏБэЪО t0ЁЋt1НзЖЮЕФЦНОљЗДгІЫйТЪЮЊ 0.004 molЁЄLЃ1ЁЄsЃ1
B. t1ЪБИУЗДгІДяЕНЦНКтЃЌ A ЕФзЊЛЏТЪЮЊ 60%
C. ИУШнЦїЕФШнЛ§ЮЊ2 LЃЌBЕФЦ№ЪМЕФЮяжЪЕФСПЮЊ 0.02 mol
D. t0ЁЋt1 НзЖЮЃЌ ДЫЙ§ГЬжаШнЦїгыЭтНчЕФШШНЛЛЛзмСПЮЊ a kJЃЌИУЗДгІЕФШШЛЏбЇЗНГЬЪНЮЊ 3A(g)![]() B(g)ЃЋ2C(g) ІЄHЃНЃ50a kJЁЄmolЃ1
B(g)ЃЋ2C(g) ІЄHЃНЃ50a kJЁЄmolЃ1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПСЊАБЃЈN2H4ЃЉМАЦфбмЩњЮяЪЧвЛРрживЊЕФЛ№М§ШМСЯЃЌN2H4гыN2O4ФмЗХГіДѓСПЕФШШЁЃ
ЃЈ1ЃЉвбжЊЃК2NO2(g)ЃНN2O4(g) ЁїHЃНЃ57.20kJЁЄmolЃ1ЁЃвЛЖЈЮТЖШЯТЃЌдкУмБеШнЦїжаЗДгІ2NO2(g)ЃНN2O4(g) ДяЕНЦНКтЁЃЦфЫќЬѕМўВЛБфЪБЃЌЯТСаДыЪЉЃК
AЃЎМѕаЁNO2ЕФХЈЖШ BЃЎНЕЕЭЮТЖШ CЃЎдіМгNO2ЕФХЈЖШ DЃЎЩ§ИпЮТЖШ
ФмЬсИпNO2зЊЛЏТЪЕФЪЧ_______ЃЈЬюзжФИЃЉЁЃ
ЃЈ2ЃЉ25ЁцЪБЃЌ1.00gN2H4(l)гызуСПN2O4(l)ЭъШЋЗДгІЩњГЩN2(g)КЭH2O (l) ЃЌЗХГі19.14kJ
ЕФШШСПЁЃдђЗДгІ2N2H4(l)+N2O4(l)ЃН3N2(g)+4H2O (l)ЕФЁїHЃН______kJЁЄmolЃ1ЁЃ
ЃЈ3ЃЉ17ЁцЁЂ1.01ЁС105PaЃЌУмБеШнЦїжаN2O4КЭNO2ЕФЛьКЯЦјЬхДяЕНЦНКтЪБЃЌc(NO2)ЃН0.0300molЁЄLЃ1ЁЂc(N2O4)ЃН0.0120molЁЄLЃ1ЁЃМЦЫуЗДгІ2 NO2(g)![]() N2O4(g)ЕФЦНКтГЃЪ§K=______ЁЃ
N2O4(g)ЕФЦНКтГЃЪ§K=______ЁЃ
ЃЈ4ЃЉЯжгУвЛЖЈСПЕФCu гызуСПЕФХЈHNO3ЗДгІЃЌжЦЕУ1.00LвбДяЦНКтЕФN2O4КЭNO2
ЛьКЯЦјЬхЃЈ17ЁцЁЂ1.01ЁС105PaЃЉЃЌРэТлЩЯжСЩйашЯћКФCuЕФжЪСПЪЧ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЛЏбЇгУгяЪщаДе§ШЗЕФЪЧЃЈ ЃЉ
A.МзЭщЕФЕчзгЪНЃК![]() B.БћЯЉЕФМќЯпЪНЃК
B.БћЯЉЕФМќЯпЪНЃК![]()
C.ввУбЕФНсЙЙЪНЃК![]() D.ввЯЉЕФНсЙЙМђЪНЃКCH2CH2
D.ввЯЉЕФНсЙЙМђЪНЃКCH2CH2
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
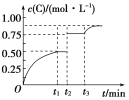
ЁОЬтФПЁПФГУмБеШнЦїжаЗЂЩњШчЯТЗДгІЃКX(g)ЃЋ3Y(g) ![]() 2Z(g)ЃЛІЄHЃМ0ЯТЭМБэЪОИУЗДгІЕФЫйТЪЃЈvЃЉЫцЪБМфЃЈtЃЉБфЛЏЕФЙиЯЕЃЌt2ЃЌt3ЃЌt5ЪБПЬЭтНчЬѕМўгаЫљИФБфЃЌЕЋЖМУЛгаИФБфИїЮяжЪЕФГѕЪММгШыСПЁЃЯТСаЫЕЗЈжае§ШЗЕФЪЧЃЈ ЃЉ
2Z(g)ЃЛІЄHЃМ0ЯТЭМБэЪОИУЗДгІЕФЫйТЪЃЈvЃЉЫцЪБМфЃЈtЃЉБфЛЏЕФЙиЯЕЃЌt2ЃЌt3ЃЌt5ЪБПЬЭтНчЬѕМўгаЫљИФБфЃЌЕЋЖМУЛгаИФБфИїЮяжЪЕФГѕЪММгШыСПЁЃЯТСаЫЕЗЈжае§ШЗЕФЪЧЃЈ ЃЉ
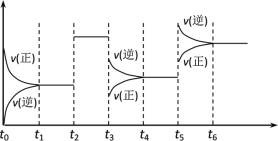
A.t2Щ§ИпЮТЖШB.t3ЪБНЕЕЭСЫЮТЖШ
C.t5ЪБдіДѓСЫбЙЧПD.t5ЁЋt6ЪБМфФкзЊЛЏТЪзюЕЭ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com