
����Ŀ��NaClO2��Ư��������Ư�۵�4��5���� NaClO2�㷺������ֽ��ҵ����ˮ�����ȡ���ҵ������NaClO2�Ĺ����������£�
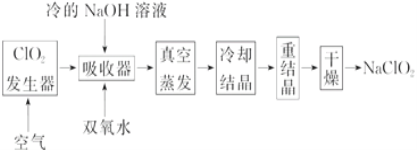
(1)ClO2�������еķ�ӦΪ��2NaClO3��SO2��H2SO4===2ClO2��2NaHSO4��ʵ�ʹ�ҵ�����У�������ơ�Ũ�������ԭ���е�SO2����ԭ��Ϊ_____________(�û�ѧ����ʽ��ʾ)��
(2)��Ӧ��������ClO2��������ͨ��һ����������Ŀ�ģ�________________________��
(3)������������NaClO2�����ӷ�Ӧ����ʽΪ___________________________________��
(4)ij��ѧ��ȤС��������ͼ��ʾװ���Ʊ�SO2��̽��SO2��Na2O2�ķ�Ӧ��
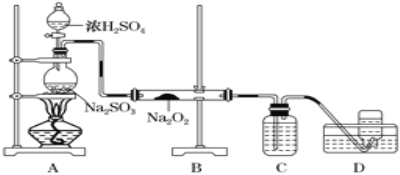
��ʢ��ŨH2SO4��������Ϊ_____��C����Һ��������____________��
��D���ռ����������ʹ�������ľ����ȼ��B�з����ķ�Ӧ����Ϊ__________��Na2O2��SO2=Na2SO4��
���𰸡�S��2H2SO4(Ũ)![]() 3SO2���� 2H2O ���ϳ�ClO2��ȷ���䱻������� 2ClO2��2OH����H2O2=2ClO2����O2��2H2O ��Һ©�� ����δ��Ӧ�Ķ������� 2Na2O2��2SO2=2Na2SO3��O2
3SO2���� 2H2O ���ϳ�ClO2��ȷ���䱻������� 2ClO2��2OH����H2O2=2ClO2����O2��2H2O ��Һ©�� ����δ��Ӧ�Ķ������� 2Na2O2��2SO2=2Na2SO3��O2
��������
�ɷ�Ӧ2NaClO3+SO2+H2SO4�T2ClO2+2NaHSO4�Ʊ�ClO2��ClO2�����NaOH��Һ��Ӧ��NaClO2��Һ�����������������ȴ�ᾧ������õ�NaClO2���ݴ˷������(1)��(3)��
(4)A�Ʊ�����������Na2O2��B�з�Ӧ��C����δ��Ӧ�Ķ�������D���ռ����������ʹ�������ľ����ȼ��˵��������������D�ռ����ɵ��������ݴ˷������
(1)ClO2�������еķ�ӦΪ��������������������������·���������ԭ��Ӧ������ǡ�Ũ����Ҳ�������ɶ�������Ӧ�ķ���ʽΪS+2H2SO4(Ũ) ![]() 3SO2��+2H2O�����Կ�����ǡ�Ũ�������ԭ���е�SO2���ʴ�Ϊ��S+2H2SO4(Ũ)
3SO2��+2H2O�����Կ�����ǡ�Ũ�������ԭ���е�SO2���ʴ�Ϊ��S+2H2SO4(Ũ) ![]() 3SO2��+2H2O��
3SO2��+2H2O��
(2)��Ӧ��������������������ClO2��ͨ��������Խ�����ȫ�ų���ȷ���䱻������գ��ʴ�Ϊ�����ϳ�ClO2��ȷ���䱻������գ�
(3)��������˫��ˮ��ClO2�ڼ��������·���������ԭ��Ӧ����NaClO2����Ӧ�����ӷ���ʽΪ2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O���ʴ�Ϊ��2ClO2+2OH-+H2O2�T2ClO2-++O2+2H2O��
(4)�ٸ���װ��ͼ��ʢ��ŨH2SO4����Ϊ��Һ©����C����Һ������������δ��Ӧ�Ķ������ʴ�Ϊ����Һ©��������δ��Ӧ�Ķ�������
��D���ռ����������ʹ�������ľ����ȼ��˵������������������B�з����ķ�Ӧ����Ϊ����������������Ʒ�Ӧ�����������ƺ���������Ӧ�ķ���ʽΪ2Na2O2+2SO2=2Na2SO3+O2���ʴ�Ϊ��2Na2O2+2SO2�T2Na2SO3+O2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��̶ȵĴ�С������ˮ���������ʾ��NaA���ε�ˮ���Ϊ��ˮ������ӵ����ʵ���ռ������ԭ�������ʵ����İٷ�����������10.0 mL 0.040 mol��L-1 NaOH��Һ��20.0 mL 0.020 mol��L-1��ijһԪ����HAǡ����ȫ�кͣ�������ҺpHΪ10��������Һ������仯���Բ��ƣ���������NaA��Һ��ˮ���Ϊ
A.1.0%B.0.75%C.0.50%D.0.25%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��̽�������ڷ�Һ����Ԫ�صļ�̬�����ⶨ�ò����ڷ�Һ����Ԫ�صĺ����Ƿ��ꡣ
![]()
(1)ʵ��һ��̽�������ڷ�Һ����Ԫ�صļ�̬��
��ͬѧ��ȡ1 mL�����ڷ�Һ������K3[Fe(CN)6]�����軯�أ���Һ��������ɫ������֤���ò����ڷ�Һ����Ԫ����Fe2+��ʽ���ڡ�
��ͬѧ��ȡ5 mL�����ڷ�Һ������10��KSCN��Һ�������ٵ���10��˫��ˮ��δ������ɫ����ͬѧΪ����û�г��ֺ�ɫʵ�������ԭ��������Һƽ����Ϊ3�ݽ���̽����
ԭ�� | ʵ����������� | ���� | ||
1 | ����ԭ��Ӱ�� | ��ͬѧ�۲�ò����ڷ�Һ�����ϱ�������������ά����C��ά����C�л�ԭ�ԣ��������Ǣ�______ | ȡ��1����Һ����������������˫��ˮ����δ����ɫ���� | �ų���_________Ӱ�� |
2 | ����ԭ�� | ���Ӣ�________��Һ��д��ѧʽ��̫�٣�����û�дﵽ��ӦŨ�� | ȡ��2����Һ�������μӸ���Һ����������Ȼδ���ֺ�ɫ | ˵�����Ǹ���Һ���ٵ�Ӱ�� |
3 | ������ʽ | ���ļ�̬��+3�ۣ������ܲ�������������Fe3+��ʽ���� | ȡ��3����Һ���μ�1��ϡ���ᣬ��ҺѸ�ٱ�Ϊ��ɫ | ˵��Fe3+�Ԣ�_______��ʽ���ڣ��û�ѧ����ʽ������֣�˵�������Ѹ���Ժ�ɫ��ԭ�� |
(2)��ͬѧע���ͬѧ��ϡ����������Һ������һ��ʱ�����ɫ�ֱ�dz�ˣ���������SCN-�и�Ԫ�صĻ��ϼۣ�Ȼ��dz�����Һ��Ϊ���ȷݣ�һ���е���KSCN��Һ�����ֺ�ɫ�ֱ����һ�ݵ���˫��ˮ�����ֺ�ɫ��ø�dz����������Ҳ�̼�����ζ���������ɡ�����ʵ�����������ӷ���ʽ��ʾ���ú���Һ��ɫ��dz��ԭ��________��
(3)ʵ��������������ڷ�Һ����Ԫ�صĺ����Ƿ��ꡣ
�ò����ڷ�Һ��ǩע������Ʒ����������(FeSO4��7H2O)ӦΪ375��425(mg/100 mL)����ʵ��С���������ʵ�飬�ⶨ������Ԫ�صĺ�������˵������ʵ����ά����C��Ӱ�����ų�������Ҫ����ά����C���ĵ�����KMnO4��Һ��
��ȡ�ò����ڷ�Һ100 mL���ֳ��ĵȷݣ��ֱ������ƿ�У����ֱ��������ϡ������
���� ________ʽ�ζ����м���0.002 mol.L-l����KMnO4��Һ������¼��ʼ�����
�۵ζ���ֱ����Һǡ��_____________��30���ڲ���ɫ����¼ĩ�����
���ظ�ʵ�顣�������ݼ��㣬ƽ����������KMnO4��Һ�����Ϊ35.00 mL������ÿ100 mL�ò����ڷ�Һ�к���Ԫ��__________mg����FeSO4��7H2O���������㣩���жϸò����ڷ�Һ����Ԫ�غ���___________����ϸ��ϸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£������й�������ȷ����
A. ��0.1 mol��L1 Na2CO3��Һ��ͨ������CO2�����c(Na+)=2[c(![]() )+c(
)+c(![]() )+c(H2CO3)]
)+c(H2CO3)]
B. �����£�pH=6��NaHSO3��Һ�У�c(![]() )c(H2SO3)=9.9��107 mol��L1
)c(H2SO3)=9.9��107 mol��L1
C. �����ʵ���Ũ�ȡ��������Na2CO3��NaHCO3��ϣ�![]() <
<![]()
D. 0.1 mol��L1 Na2C2O4��Һ��0.1 mol��L1 HCl��Һ�������ϣ�H2C2O4Ϊ��Ԫ���ᣩ��2c(![]() )+c(
)+c(![]() )+c(OH)=c(Na+)+c(H+)
)+c(OH)=c(Na+)+c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A. ����ʽΪC4H8�л���������4��C��C����
B. ![]() ��
��![]() ���Ƿ�������
���Ƿ�������![]() ���Ƿ��������Ƿ��㻯����
���Ƿ��������Ƿ��㻯����
C. ![]() ��
��![]() ����������һ����CH2���������ͬϵ���ϵ
����������һ����CH2���������ͬϵ���ϵ
D. ����ʽΪC2H6O�ĺ������ͼ�Ϸ�����C��H����C��O���������գ��ɴ˿��Գ����Ʋ��л���ṹ��ʽΪC2H5��OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ˮ�к�5.00��10-3mol��L-1��![]() ���䶾�Խϴ�ij�о���ѧϰС��Ϊ�˱��Ϊ��������ˮ�����õ����Բ���
���䶾�Խϴ�ij�о���ѧϰС��Ϊ�˱��Ϊ��������ˮ�����õ����Բ���![]() ��
��![]() �Ļ��ϼ�����Ϊ+3��+2�������������ʵ�����̣�
�Ļ��ϼ�����Ϊ+3��+2�������������ʵ�����̣�

��1����������Ӧ�����ӷ���ʽ��_________________________________________________��
��2������������pH��ֽ�ⶨ��ҺpH�IJ����ǣ�
______________________________________________________________________________��
��3�����������˵õ�����������Ҫ�ɷֳ�Cr��OH��3�⣬����______________________��
��4����ʹ1L�÷�ˮ�е�![]() ��ȫת��Ϊ
��ȫת��Ϊ![]() ����������Ҫ����__________g FeSO4��7H2O��
����������Ҫ����__________g FeSO4��7H2O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪��1molH-H��,1molN-H��,1mol![]() ���ֱ���Ҫ��������436kJ��391kJ��946kJ,��N2��H2��Ӧ����NH3���Ȼ�ѧ����ʽΪ________��
���ֱ���Ҫ��������436kJ��391kJ��946kJ,��N2��H2��Ӧ����NH3���Ȼ�ѧ����ʽΪ________��
��2����2A+B![]() 2C+D��Ӧ��,��ʾ�÷�Ӧ������_____(��д��ĸ���)��
2C+D��Ӧ��,��ʾ�÷�Ӧ������_____(��д��ĸ���)��
a. v(A)=0.8molL-1s-1
b. v(B)=0.3molL-1s-1
c. v(C)=0.6molL-1s-1
d.v(D)=0.5molL-1s-1
��3��90��ʱ,amolL-1һԪ��HA��bmolL-1NaOH��Һ�������Ϻ�,���Һ��pHΪ7,����Һ���������ӵ�Ũ���ɴ�С��˳����________��
��4������ͼ�У����ձ���ʢ��100 mL 0.50 molL��1 AgNO3��Һ�����ձ���ʢ��100 mL 0.25 molL��1 CuCl2��Һ��A��B��C��D��Ϊ������ͬ��ʯī�缫��������һ��ʱ�����A����C����0.19 g�����ԴEΪ________����A���ĵ缫��ӦʽΪ_______��D����������________ mL(��״��)��
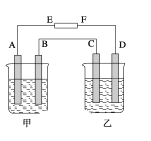
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ִ�ֲ������ȡ����Ȼ������a-damascone����������������ˮ������ṹΪ��
 ���йظû����������˵������ȷ����
���йظû����������˵������ȷ����
A. ����ʽΪ![]() B. �û�����ɷ����ۺϷ�ӦC. 1mol�û�������ȫȼ������19mol
B. �û�����ɷ����ۺϷ�ӦC. 1mol�û�������ȫȼ������19mol![]() D. �����
D. �����![]() ��Һ��Ӧ���ɵIJ��ᆳˮ�⡢ϡ���ữ�����
��Һ��Ӧ���ɵIJ��ᆳˮ�⡢ϡ���ữ�����![]() ��Һ����
��Һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Ӧ�з�Ӧ�����������У�AsH3��H2SO4��![]() ��H3AsO4��H2O��һ��δ֪����X��
��H3AsO4��H2O��һ��δ֪����X��
��1����֪![]() �ڷ�Ӧ�еõ����ӣ���÷�Ӧ�Ļ�ԭ����______________��
�ڷ�Ӧ�еõ����ӣ���÷�Ӧ�Ļ�ԭ����______________��
��2����֪0.2mol![]() �ڷ�Ӧ�еõ�1mol��������X����X�Ļ�ѧʽΪ_____________��
�ڷ�Ӧ�еõ�1mol��������X����X�Ļ�ѧʽΪ_____________��
��3������������Ӧ����֪_________��
a�������ԣ�![]() b�������ԣ�
b�������ԣ�![]()
c����ԭ�ԣ�![]() d����ԭ�ԣ�
d����ԭ�ԣ�![]()
��4�����������ͻ�ԭ���Ļ�ѧʽ������ƽ���ϵ���������з����У����������ת�Ƶķ�
�����Ŀ�� ___________��
___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com