
【题目】(1)已知拆开1molH-H键,1molN-H键,1mol![]() 键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________。
键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________。
(2)在2A+B![]() 2C+D反应中,表示该反应最快的是_____(填写字母序号)。
2C+D反应中,表示该反应最快的是_____(填写字母序号)。
a. v(A)=0.8molL-1s-1
b. v(B)=0.3molL-1s-1
c. v(C)=0.6molL-1s-1
d.v(D)=0.5molL-1s-1
(3)90℃时,amolL-1一元酸HA与bmolL-1NaOH溶液等体积混合后,混合液的pH为7,则溶液中所有离子的浓度由大到小的顺序是________。
(4)在如图中,甲烧杯中盛有100 mL 0.50 molL-1 AgNO3溶液,乙烧杯中盛有100 mL 0.25 molL-1 CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重0.19 g,则电源E为________极,A极的电极反应式为_______,D极析出气体________ mL(标准状况)。
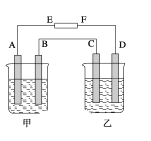
【答案】N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92kJ/mol d c(Na+)>c(A-)>c(OH-)>c(H+) 负 Ag++e-=Ag 28mL
2NH3(g) ΔH=-92kJ/mol d c(Na+)>c(A-)>c(OH-)>c(H+) 负 Ag++e-=Ag 28mL
【解析】
利用反应热与键能的关系计算ΔH,根据同种物质表示的反应速率比较反应快慢,利用溶液中的电荷守恒关系比较离子浓度,一定时间内通过串联电解池各电极的电量相等进行计算。
(1)N2与H2反应生成NH3的热化学方程式可写成N2(g)+3H2(g)![]() 2NH3(g) ΔH,据反应热=反应物总键能-生成物总键能,有ΔH=(946kJ/mol+436kJ/mol×3)-391kJ/mol×6=-92kJ/mol。故热化学方程式可写成N2(g)+3H2(g)
2NH3(g) ΔH,据反应热=反应物总键能-生成物总键能,有ΔH=(946kJ/mol+436kJ/mol×3)-391kJ/mol×6=-92kJ/mol。故热化学方程式可写成N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92kJ/mol。
2NH3(g) ΔH=-92kJ/mol。
(2)比较不同条件下反应2A+B![]() 2C+D进行的快慢,应转换成同一物质表示的反应速率,且速率单位相同。现转换成物质A表示的速率,a. v(A)=0.8molL-1s-1;b. v(B)=0.3molL-1s-1 ,则v(A)=0.6molL-1s-1;c. v(C)=0.6molL-1s-1,则v(A)=0.6molL-1s-1;d.v(D)=0.5molL-1s-1,则v(A)=1.0 molL-1s-1。故该反应最快的是d。
2C+D进行的快慢,应转换成同一物质表示的反应速率,且速率单位相同。现转换成物质A表示的速率,a. v(A)=0.8molL-1s-1;b. v(B)=0.3molL-1s-1 ,则v(A)=0.6molL-1s-1;c. v(C)=0.6molL-1s-1,则v(A)=0.6molL-1s-1;d.v(D)=0.5molL-1s-1,则v(A)=1.0 molL-1s-1。故该反应最快的是d。
(3)90℃时,水的离子积Kw>1.0×10-14,故中性溶液的pH<7。题中混合溶液中只有四种离子,符合电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-)。90℃溶液pH=7为弱碱性溶液,故有c(Na+)>c(A-)>c(OH-)>c(H+)。
(4)图中,用惰性电极串联电解AgNO3溶液(甲)、CuCl2溶液(乙)。A极比C极重0.19 g,则A、C为阴极,电源E为负极。电极A、B、C、D的电极反应分别为Ag++e-=Ag、2H2O-4e-=O2↑+4H+、Cu2++2e-=Cu、2Cl--2e-=Cl2↑。电解时通过四电极的电子物质的量相等,设为x,则A极析出m(Ag)=108g/mol×x,C极析出m(Cu)=64g/mol×![]() 。据题意,有108g/mol×x-64g/mol×/span>
。据题意,有108g/mol×x-64g/mol×/span>![]() =0.19g,解得x=0.0025mol。故D极生成氯气在标准状况时体积V(Cl2)=(0.0025mol÷2)×22.4L/mol=0.028L=28mL。
=0.19g,解得x=0.0025mol。故D极生成氯气在标准状况时体积V(Cl2)=(0.0025mol÷2)×22.4L/mol=0.028L=28mL。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】煤炭被人们誉为黑色的“金子”,它是人类使用的主要能源之一。为了提高煤的利用率,减少有害气体的排放,人们采取了各式各样的方法。
(1)煤的气化和液化可能提高煤的利用率。煤的气化技术的主要产物是___________。煤的液化技术又分为直接液化和间接氧化.将煤隔绝空气加强热得到焦炉气、煤焦油及焦炭等产品的技术称为___________。
(2)煤在燃烧前、后及燃烧过程中均可采取措施减少有害气体的排放.
①在燃烧前,可以采用微生物脱硫技术.原理如下:
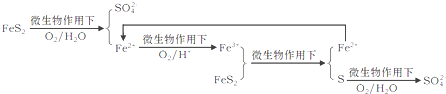
上述过程中Fe2+的作用为________________。写出Fe2+![]() Fe3+的离子方程式________________。
Fe3+的离子方程式________________。
②煤在燃烧时,进行脱硫处理,常采用________燃烧技术,在把煤和脱硫剂加入锅炉燃烧室,使煤与空气在流化过程中充分混合、燃烧,起到固硫作用.常用脱硫剂的主要化学成分为_______(填化学式)。
③煤在燃烧后,烟气净化常采用除尘技术和脱硫、脱硝技术.湿法脱硫、脱硝技术中将烟气通入_________设备,用石灰水淋洗。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) ΔH=-285kJ/mol
O2(g)=H2O(l) ΔH=-285kJ/mol
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ/mol
O2(g)=H2O(g) ΔH=-241.8kJ/mol
③C(s)+![]() O2(g)=CO(g) ΔH=-110.4 kJ/mol
O2(g)=CO(g) ΔH=-110.4 kJ/mol
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列各问:
(1)上述反应中属于放热反应的是__。
(2)C的燃烧热为___。
(3)燃烧10gH2生成液态水,放出的热量为___。
(4)CO燃烧的热化学方程式为___。
(5)为了控制温室效应,各国科学家提出了不少设想。有人根据液态CO2密度大于海水密度的事实,设想将CO2液化后,送入深海海底,以减少大气中的CO2。为使CO2液化,可采取的措施__。
a.减压、升温 b.增压、降温 c.减压、降温 d.增压、升温
(6)写出下列反应的热化学方程式,N2(g)与适量H2(g)反应,生成2molNH3(g),放出92.2kJ热量___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2的漂白能力是漂白粉的4~5倍, NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
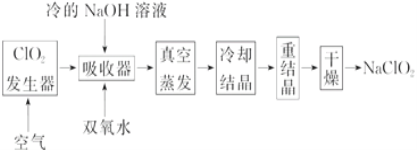
(1)ClO2发生器中的反应为:2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4。实际工业生产中,可用硫黄、浓硫酸代替原料中的SO2,其原因为_____________(用化学方程式表示)。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的:________________________。
(3)吸收器中生成NaClO2的离子反应方程式为___________________________________。
(4)某化学兴趣小组用如下图所示装置制备SO2并探究SO2与Na2O2的反应:
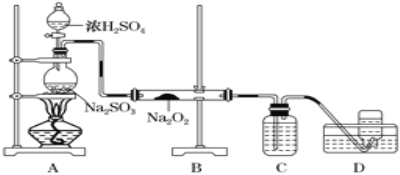
①盛放浓H2SO4仪器名称为_____,C中溶液的作用是____________。
②D中收集到的气体可使带余烬的木条复燃,B中发生的反应可能为__________、Na2O2+SO2=Na2SO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+I2(g)![]() 2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
起始物质的量 | n(H2)/mol | n(I2)/mol | n(HI)/mol |
甲 | 0.02 | 0.02 | 0 |
乙 | 0.04 | 0.04 | 0 |
A. 平衡时,乙中H2的转化率是甲中的2倍
B. 平衡时,甲中混合物的颜色比乙中深
C. 平衡时,甲、乙中热量的变化值相等
D. 该温度下,反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是
![]()
![]() A. ④①②⑤⑥③ B. ④①②⑥⑤③
A. ④①②⑤⑥③ B. ④①②⑥⑤③
![]()
![]() C. ①④②⑥③⑤ D. ①④②③⑥⑤
C. ①④②⑥③⑤ D. ①④②③⑥⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25 ℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D. 80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将1 mol气体A和1 mol气体B充入2 L某密闭容器中,发生反应:![]() ,
,![]() 时达到平衡。在
时达到平衡。在![]() 、
、![]() 时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化的曲线如图所示。下列说法正确的是( )
时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化的曲线如图所示。下列说法正确的是( )
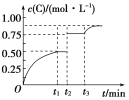
A.![]() 时改变的条件是使用催化剂
时改变的条件是使用催化剂
B.反应的化学方程式中,![]()
C.![]() 间该反应的平衡常数均为5
间该反应的平衡常数均为5
D.![]() 时改变的条件是移去少量物质D
时改变的条件是移去少量物质D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4能放出大量的热。
(1)已知:2NO2(g)=N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)=N2O4(g) 达到平衡。其它条件不变时,下列措施:
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
能提高NO2转化率的是_______(填字母)。
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O (l) ,放出19.14kJ
的热量。则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O (l)的△H=______kJ·mol-1。
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L-1、c(N2O4)=0.0120mol·L-1。计算反应2 NO2(g)![]() N2O4(g)的平衡常数K=______。
N2O4(g)的平衡常数K=______。
(4)现用一定量的Cu 与足量的浓HNO3反应,制得1.00L已达平衡的N2O4和NO2
混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu的质量是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com