
| A、氢化物沸点:HI>HBr>HCl>HF |
| B、分子稳定性:HF>H2O>H2S |
| C、离子半径:K+>Cl->S2- |
| D、单质的熔点:Li<Na<K<Rb |


科目:高中化学 来源: 题型:
| A、氨水加水稀释,溶液中各离子浓度均减小 |
| B、Na2S和NaHS的混合溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| C、1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 |
| D、在温度不变的条件下向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4将会析出,Ksp也会发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、取代,4mol Cl2 |
| B、加成,2mol Cl2 |
| C、加成、取代,2mol Cl2 |
| D、加成、取代,3mol Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正反应和逆反应的速率都为零 |
| B、容器内各物质的浓度不随时间变化 |
| C、容器内X、Y、Z的浓度之比为1:2:2 |
| D、单位时间消耗0.1mol X同时生成0.2mol Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+、CO32-、K+、Na+ |
| B、Na+、Ba2+、Cl-、HCO3- |
| C、NO3-、Cu2+、K+、SO42- |
| D、NO3-、K+、CO32-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
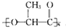 ,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )| A、聚乳酸是一种纯净物 |
B、聚乳酸的单体是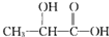 |
| C、聚乳酸是一种羧酸 |
| D、聚乳酸是由其单体通过加聚反应合成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com