
ЁОЬтФПЁПКЌЕЊЛЏКЯЮягыЩњВњЁЂЩњЛюЁЂЩњУќКЭЛЗОГЯЂЯЂЯрЙиЁЃ
(1)NOМгЫйГєбѕВуБЛЦЦЛЕЃЌЦфЗДгІЙ§ГЬШчЭМЫљЪОЁЃ
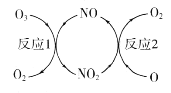
ЂйNOЕФзїгУЪЧ________________________ЁЃ
ЂквбжЊЃКO3(g)+O(g) ЃН2O2(g) ЁїH=-143kJЁЄmol-1
ЗДгІlЃКO3(g)+NO(g) ЃНNO2(g)+O2(g)ЁїH1=-200.2kJЁЄmol-1
дђЗДгІ2ЕФШШЛЏбЇЗНГЬЪНЮЊ____________________________ЁЃ
(2)МЁКьЕААз(Mb)ЪЧМЁШтФкДЂДцбѕЕФЕААзжЪЃЌЙЙГЩМЁКьЕААзЕФИЪАБЫс(H2NCH2COOH)ЪЧвЛжжСНадЮяжЪЃЌдкШмвКжавдШ§жжРызгаЮЪНДцдкЃЌЦфзЊЛЏЙиЯЕШчЯТ Ш§жжРызгЕФЮяжЪЕФСПЗжЪ§(ІФ)гы[
Ш§жжРызгЕФЮяжЪЕФСПЗжЪ§(ІФ)гы[![]() ]ЕФЙиЯЕШчЭМЫљЪОЁЃ
]ЕФЙиЯЕШчЭМЫљЪОЁЃ
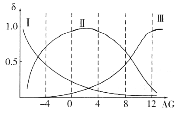
ЂйШмвКГЪжаадЪБЃЌШ§жжРызгХЈЖШгЩДѓЕНаЁЕФЫГађЮЊ______________________ЁЃ
ЂкЯђAG=12ЕФШмвКжаМгШыЙ§СПNaOHШмвКЪБЃЌжївЊЗДгІЕФРызгЗНГЬЪНЮЊ______________ЁЃ
(3)МЁКьЕААз(Mb)ПЩгыO2НсКЯЩњГЩMbO2ЃК![]() ЁЃ37ЁцЪБВтЕУМЁКьЕААзЕФНсКЯЖШ(ІС)гыp(O2)ЕФЙиЯЕШчЯТБэЁЃ
ЁЃ37ЁцЪБВтЕУМЁКьЕААзЕФНсКЯЖШ(ІС)гыp(O2)ЕФЙиЯЕШчЯТБэЁЃ
[НсКЯЖШ(ІС)жИвбгыO2НсКЯЕФМЁКьЕААзеМзмМЁКьЕААзЕФЮяжЪЕФСПЗжЪ§]
p(O2)ЃЏkPa | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
ІС(MbO2)% | 50.0 | 66.7 | 80.0 | 85.7 | 88.9 | 90.9 | 92.3 |
ЂйМЦЫу37ЁцЪБЃЌЩЯЪіЗДгІЕФЦНКтГЃЪ§K=__________kPa-1(ЦјЬхКЭШмвКжаЕФШмжЪЗжБ№гУЗжбЙКЭЮяжЪЕФСПХЈЖШБэЪО)ЁЃ
Ђк37ЁцЪБЃЌШєПеЦјжабѕЦјЗжбЙЮЊ21.0 kPaЃЌдђШЫе§ГЃКєЮќЪБІСЕФзюДѓжЕЮЊ________ЃЅ(БЃСє1ЮЛаЁЪ§)ЁЃ
ЂлЮТЖШВЛБфЪБЃЌгЮПЭдкЩНЖЅЪБЬхФкMbO2ЕФХЈЖШБШдкЩНЯТ________(ЬюЁАИпЁБЛђЁАЕЭЁБ)ЁЃ
ЂмбаОПЗЂЯжЃЌvе§=kе§ЁЄc(Mb)ЁЄp(O
ЁОД№АИЁПДпЛЏМС NO2ЃЈgЃЉ+OЃЈgЃЉ=NO(g)+O2(g) ЁїH=+57.2KJ/mol c(H3N+CH2COOЃ)>cЃЈH2NCH2COOЃЃЉ>c(H3N+CH2COOH) H3N+CH2COOH+2OHЃ= H2NCH2COOЃ+2H2O 2 97.7 ЕЭ 120s-1 KPa-1
ЁОНтЮіЁП
(1)ЂйNOжЛЪЧВЮгыЛЏбЇЗДгІжаМфРњГЬЕФЃЌЖјЦфБОЩэЕФЪ§СПКЭЛЏбЇаджЪдкЗДгІЧАКѓЛљБОБЃГжВЛБфЃЛ
ЂкРћгУИЧЫЙЖЈТЩНтЬтЃЛ
(2)ЫцзХКсзјБъдіДѓЃЌМюадМѕШѕЃЌЫсаддіЧПЃЌИљОн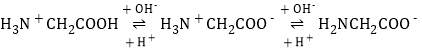 ПЩжЊH2NCH2COOЃМюаддНЧПКЌСПдНДѓЃЌH3N+CH2COOЃдкНгНќжаадЪБКЌСПзюДѓЃЌH3N+CH2COOHЫсаддНЧПКЌСПдНДѓЃЌгЩДЫШЗЖЈЂёЯпЮЊH2NCH2COOЃ,ЂђЯпЮЊH3N+CH2COOЃ,ЂѓЯпЮЊH3N+CH2COOHЃЌвдДЫЗжЮіЃЛ
ПЩжЊH2NCH2COOЃМюаддНЧПКЌСПдНДѓЃЌH3N+CH2COOЃдкНгНќжаадЪБКЌСПзюДѓЃЌH3N+CH2COOHЫсаддНЧПКЌСПдНДѓЃЌгЩДЫШЗЖЈЂёЯпЮЊH2NCH2COOЃ,ЂђЯпЮЊH3N+CH2COOЃ,ЂѓЯпЮЊH3N+CH2COOHЃЌвдДЫЗжЮіЃЛ
(3)ЂйK=![]() kPa-1ЃЌРћгУБэИёжаЪ§ОнНјааМЦЫуЃЛ
kPa-1ЃЌРћгУБэИёжаЪ§ОнНјааМЦЫуЃЛ
ЂкРћгУЂйжаМЦЫуЕФKМЦЫуМДПЩЃЛ
ЂлИљОнБэИёЬсЙЉЪ§ОнПЩжЊp(O2)дНаЁЃЌНсКЯЖШдНЕЭЃЌcЃЈMbO2ЃЉдНаЁЃЛ
ЂмРћгУЂйжаМЦЫуЕФKЃЌИљОнЦНКтЪБvе§= vФцНјааМЦЫуЃЛ
(1)ЂйNOжЛЪЧВЮгыЛЏбЇЗДгІжаМфРњГЬЕФЃЌЖјЦфБОЩэЕФЪ§СПКЭЛЏбЇаджЪдкЗДгІЧАКѓЛљБОБЃГжВЛБфЃЌвђДЫNOЕФзїгУЪЧДпЛЏМСЃЛ
Д№АИЃКДпЛЏМС
ЂкРћгУИЧЫЙЖЈТЩЃЌИљОнвбжЊЃЛO3(g)+O(g) =2O2(g) ЁїH=-143kJЁЄmol-1
O3(g)+NO(g) =NO2(g)+O2(g)ЁїH1=-200.2kJЁЄmol-1
ЧАепМѕШЅКѓепПЩЕУЃКNO2ЃЈgЃЉ+OЃЈgЃЉ=NO(g)+O2(g) ЁїH=+57.2kJ/mol
Д№АИЃКNO2ЃЈgЃЉ+OЃЈgЃЉ=NO(g)+O2(g) ЁїH=+57.2kJ/mol
(2)ЂйЫцзХКсзјБъдіДѓЃЌМюадМѕШѕЃЌЫсаддіЧПЃЌИљОнЬтИЩПЩжЊМюаддНЧПH2NCH2COOЃКЌСПдНДѓЃЌдкAG=0ЁЋ4ЗЖЮЇЪБH3N+CH2COOЃКЌСПзюДѓЃЌЫсаддНЧПH3N+CH2COOHКЌСПдНДѓЃЌгЩДЫШЗЖЈЂёЯпЮЊH2NCH2COOЃ,ЂђЯпЮЊH3N+CH2COOЃ,ЂѓЯпЮЊH3N+CH2COOHЃЌШмвКГЪжаадвВОЭЪЧAG=0ЃЌШ§жжРызгХЈЖШгЩДѓЕНаЁЕФЫГађПЩИљОнЭМЯёЕУЕНЮЊc(H3N+CH2COOЃ)>cЃЈH2NCH2COOЃЃЉ>c(H3N+CH2COOH)ЃЛ
Д№АИЃКc(H3N+CH2COOЃ)>cЃЈH2NCH2COOЃЃЉ>c(H3N+CH2COOH)
ЂкИљОн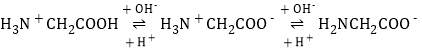 ПЩжЊМгШыЙ§СПNaOHШмвКЪБШмвКжажївЊДцдкH2NCH2COO-ЃЌAG=12ЪБШмвКжажївЊДцдкH3N+CH2COOHЃЌОнДЫаДГіРызгЗНГЬЪНЮЊ: H3N+CH2COOH+2OHЃ= H2NCH2COOЃ+2H2OЃЛ
ПЩжЊМгШыЙ§СПNaOHШмвКЪБШмвКжажївЊДцдкH2NCH2COO-ЃЌAG=12ЪБШмвКжажївЊДцдкH3N+CH2COOHЃЌОнДЫаДГіРызгЗНГЬЪНЮЊ: H3N+CH2COOH+2OHЃ= H2NCH2COOЃ+2H2OЃЛ
Д№АИЃКH3N+CH2COOH+2OHЃ= H2NCH2COOЃ+2H2O
(3)ЂйK=![]() kPa-1ЃЌРћгУБэИёжаЕквЛзщЪ§ОнПЩжЊЃКЩшМЁКьЕААззмХЈЖШc
kPa-1ЃЌРћгУБэИёжаЕквЛзщЪ§ОнПЩжЊЃКЩшМЁКьЕААззмХЈЖШc
![]()
cЁСЃЈ1-50%ЃЉ 0.50kPa cЁС50%
K=![]() =2
=2
ЂкРћгУЂйжаМЦЫуЫљЕУK=2МЦЫуМДПЩЃЛ
2=![]() ЃЌЕУІС=97.7ЃЛ
ЃЌЕУІС=97.7ЃЛ
Д№АИЃК97.7
ЂлИљОнБэИёЬсЙЉЪ§ОнПЩжЊp(O2)дНаЁЃЌНсКЯЖШдНЕЭЃЌ MbO2ХЈЖШдНЕЭЃЛ
Д№АИЃКЕЭ
ЂмРћгУЂйжаМЦЫуЕФK=2ЃЌИљОнЦНКтЪБvе§= vФцНјааМЦЫуЃЛ
ЦНКтЪБvе§= vФцЃЌ дђkе§ЁЄc(Mb)ЁЄp(O2)=kФцЁЄc(MbO2)ЃЌЕУKе§=![]() = kФцЁСK=60s-1ЁС2kPa-1=120s-1 KPa-1ЃЛ
= kФцЁСK=60s-1ЁС2kPa-1=120s-1 KPa-1ЃЛ
Д№АИ: 120s-1 KPa-1



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЪвгУЯТСавЧЦїзщзАвЛЬзЪЏгЭЗжСѓЕФзАжУЃЌВЂНјааЯрЙиЪЕбщЃЌПЩвдЕУЕНЦћгЭКЭУКгЭЁЃ

(1)аДГіЯТСавЧЦїЕФУћГЦЃК
Ђй________ЃЛЂк________ЃЛЂл________ЁЃ
(2)НЋвдЩЯвЧЦїАДДгзѓЕНгвЕФЫГађЃЌгУзжФИaЁЂbЁЂcЁЁНјааСЌНгЃКeНгЃЈ____ЃЉНгЃЈ____ЃЉНгЃЈ____ЃЉНгЃЈ____ЃЉНгЃЈ____ЃЉНгЃЈ____ЃЉНгЃЈ____ЃЉНгЃЈ____ЃЉНгЃЈ____ЃЉЁЃ
(3)вЧЦїЂкжаAЪЧ________(ЬюЁАНјЫЎПкЁБЛђЁАГіЫЎПкЁБЃЌЯТЭЌ)ЃЌBЪЧ________ЁЃ
(4)еєСѓЪБЃЌЮТЖШМЦЫЎвјЧђгІдк________(ЮЛжУ)ЁЃ
(5)дкЂйжазЂШыдгЭКѓЃЌМгМИЦЌЫщДЩЦЌЕФФПЕФЪЧ_______
(6)дкЪЕбщНсЪјКѓЃЌЮЊСЫЬНОПЪЏгЭжаЪЧЗёКЌгаЯЉЬўЃЌФГбЇЩњгУЂлжаЕФЮяжЪзіСЫвЛИіЬНОПЪЕбщЃЌЦфВйзїЁЂЯжЯѓМАНсТлЪЧ________
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЖЬжмЦкдЊЫиaЁЂbЁЂcЁЂdЕФдзгађЪ§вРДЮдіДѓЃЌaКЭbЕФзюЭтЕчзгЪ§жЎКЭЕШгкcКЭdЕФзюЭтВуЕчзгЪ§жЎКЭЃЌетЫФжждЊЫизщГЩСНжжбЮb2da3КЭbca2ЁЃдкКЌИУСНжжбЮЕФЛьКЯШмвКжаЕЮМгбЮЫсЃЌВњЩњАзЩЋГСЕэЕФЮяжЪЕФСПгыбЮЫсЬхЛ§ЕФЙиЯЕШчЭМЫљЪОЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ

A. 1mol dЕФбѕЛЏЮяКЌ2mol ЛЏбЇМќ
B. ЙЄвЕЩЯЕчНтcЕФбѕЛЏЮявБСЖЕЅжЪc
C. дзгАыОЖЃКa < b < c < d
D. МђЕЅЧтЛЏЮяЕФЗаЕуЃКa < d
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЪвПЩгУЙЬЬхЖўбѕЛЏУЬгыХЈбЮЫсдкМгШШЬѕМўЯТжЦШЁТШЦјЃЌЛЏбЇЗНГЬЪНЮЊMnO2+4HCl(ХЈ)![]() MnCl2+Cl2Ёќ+2H2OЃЌвбжЊХЈбЮЫсвзЛгЗЂЁЃФГбЇЩњЩшМЦШчЯТЭМЫљЪОЕФЪЕбщзАжУЃЌРћгУТШЦјгыГБЪЊЕФЪьЪЏЛвЗДгІжЦШЁЩйСПЦЏАзЗл(етЪЧвЛИіЗХШШЗДгІ)ЁЃЛиД№ЯТСаЮЪЬтЃК
MnCl2+Cl2Ёќ+2H2OЃЌвбжЊХЈбЮЫсвзЛгЗЂЁЃФГбЇЩњЩшМЦШчЯТЭМЫљЪОЕФЪЕбщзАжУЃЌРћгУТШЦјгыГБЪЊЕФЪьЪЏЛвЗДгІжЦШЁЩйСПЦЏАзЗл(етЪЧвЛИіЗХШШЗДгІ)ЁЃЛиД№ЯТСаЮЪЬтЃК

(1)AзАжУЮЊЪЕбщЪвжЦШЁТШЦјЕФзАжУЃЌAзАжУжаЗДгІЕФРызгЗНГЬЪНЮЊ__________________ЁЃ
(2)ЦЏАзЗлНЋдкUаЮЙмжаВњЩњЃЌЦфЛЏбЇЗНГЬЪНЪЧ___________________________________ЁЃ
(3)CзАжУЕФзїгУЪЧ____________________ЁЃ
(4)ДЫЪЕбщЫљЕУЦЏАзЗлЕФгааЇГЩЗжЦЋЕЭЃЌИУбЇЩњОЗжЮіВЂВщдФзЪСЯЗЂЯжЃЌжївЊдвђЪЧдкUаЮЙмжаЛЙДцдкСНИіИБЗДгІЁЃ
ЂйЮТЖШНЯИпЪБТШЦјгыЪьЪЏЛвЗДгІЩњГЩCa(ClO3)2ЃЌЮЊБмУтДЫИБЗДгІЕФЗЂЩњЃЌПЩВЩШЁЕФДыЪЉЪЧ____________________ЁЃ
ЂкЪдХаЖЯСэвЛИіИБЗДгІ_____________________________________(гУЛЏбЇЗНГЬЪНБэЪО)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙЄвЕЩЯжЦБИH2ЕФвЛжжживЊЗНЗЈЪЧЃКCO(g)ЃЋH2O(g) ![]() CO2(g)ЃЋH2(g)ЁЁІЄHЃНQ kJЁЄmolЈD1ЁЃвбжЊИУЗДгІЕФЦНКтГЃЪ§KгыЮТЖШЕФЙиЯЕШчЭМЫљЪОЁЃШєдквЛЙЬЖЈЕФУмБеШнЦїжаЃЌ850 ЁцЪБЗЂЩњЩЯЪіЗДгІЃЌВЂВтЕУШнЦїФкИїЮяжЪЕФХЈЖШ(molЁЄLЈD1)ЫцЪБМфЕФБфЛЏЙиЯЕШчЯТБэЃК
CO2(g)ЃЋH2(g)ЁЁІЄHЃНQ kJЁЄmolЈD1ЁЃвбжЊИУЗДгІЕФЦНКтГЃЪ§KгыЮТЖШЕФЙиЯЕШчЭМЫљЪОЁЃШєдквЛЙЬЖЈЕФУмБеШнЦїжаЃЌ850 ЁцЪБЗЂЩњЩЯЪіЗДгІЃЌВЂВтЕУШнЦїФкИїЮяжЪЕФХЈЖШ(molЁЄLЈD1)ЫцЪБМфЕФБфЛЏЙиЯЕШчЯТБэЃК
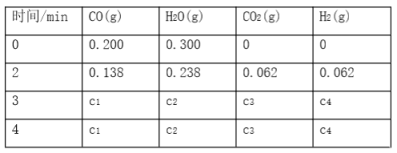
вбжЊЃК850 ЁцЪБИУЗДгІЕФЛЏбЇЦНКтГЃЪ§KЃН1.0ЃЌЧыЛиД№ЯТСаЮЪЬтЃК
(1)ЯТСаПЩвдХаЖЯИУЗДгІДяЕНЛЏбЇЦНКтзДЬЌЕФЪЧ________ЁЃ
AЃЎЕЅЮЛЪБМфФкМѕЩйCO(g)ЕФХЈЖШЕШгкЩњГЩCO2(g)ЕФХЈЖШ
BЃЎЗДгІШнЦїФкЕФбЙЧПВЛЗЂЩњБфЛЏ
CЃЎЛьКЯЦјЬхжаH2(g)ЕФХЈЖШВЛдйЗЂЩњИФБф
DЃЎЧтЦјЕФЩњГЩЫйТЪЕШгкЫЎЕФЯћКФЫйТЪ
(2)Q______0(ЬюЁАЃОЁБЁАЃНЁБЛђЁАЃМЁБ)ЁЃ
(3)Шєдк850 ЁцЪБЯђЗДгІШнЦїжаГфШыH2O(g)ЃЌKжЕ________________(ЬюЁАдіДѓЁБЁАМѕаЁЁБЛђЁАВЛБфЁБ)ЁЃ
(4)ЩЯБэжаc2ЮЊ________________ЃЌCO(g)ЕФзЊЛЏТЪЮЊ________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПKIЙуЗКгІгУгкЗжЮіЪдМСЁЂИаЙтВФСЯЁЂжЦвЉКЭЪГЦЗЬэМгМСЕШЁЃЪЕбщЪвжЦБИKIЕФзАжУШчЯТЭМЫљЪОЁЃ

вбжЊЃКЂй3I2+6KOH![]() 5KI+KIO3+3H2OЂк3H2S+KIO3
5KI+KIO3+3H2OЂк3H2S+KIO3![]() KI+3SЁ§+3H2O
KI+3SЁ§+3H2O
(1)РћгУЩЯЭМзАжУжЦБИKIЃЌЦфСЌНгЫГађЮЊ_____________(АДЦјСїЗНЯђЃЌгУаЁаДзжФИБэЪО)ЁЃ
(2)МьВщзАжУAЦјУмадЕФЗНЗЈЪЧ____________ЃЛзАжУDЕФзїгУЪЧ____________________ЁЃ
(3)жЦБИKIЪБЃЌЯђШ§ОБЦПжаж№ЕЮЕЮШыKOHШмвКЃЌМгШШВЂВЛЖЯНСАшЃЌЙлВьЕНзиЛЦЩЋШмвКБфЮЊЮоЩЋЪБЃЌСЂМДЭЃжЙЕЮМгKOHШмвКЃЌШЛКѓЭЈШызуСПH2SЦјЬхЁЃ
ЂйЗДгІНсЪјКѓЃЌЯђШ§ОБЦПжаМгШыСђЫсШмвКВЂМгШШЃЌПЩвдГ§ШЅKIШмвКжаЕФH2SЃЌдвђЪЧ________________________________________ЁЃ
ЂкгУыТ(N2H4)ЬцДњH2SЃЌжЦЕУВњЦЗДПЖШИќИпЃЌРэгЩЪЧ_______________(гУЛЏбЇЗНГЬЪНБэЪО)ЁЃ
(4)ЩшМЦЪЕбщЗНАИГ§ШЅKIШмвКжаЕФЯЁСђЫс_____________________________ЁЃ
(5)ШєЕУЕН1.6gСђЕЅжЪЃЌРэТлЩЯжЦЕУKIЕФжЪСПЮЊ_________________gЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПаТФмдДЦћГЕЕФКЫаФВПМўЪЧяЎРызгЕчГиЃЌГЃгУСзЫсбЧЬњяЎЃЈLiFePO4ЃЉзіЕчМЋВФСЯЁЃЖдLiFePO4ЗЯОЩЕчМЋЃЈКЌдгжЪAlЁЂЪЏФЋЗлЃЉЛиЪеВЂЛёЕУИпДПLi2CO3ЕФЙЄвЕСїГЬЭМШчЯТЃК

зЪСЯЃКЬМЫсяЎдкЫЎжаШмНтЖШЃК
ЮТЖШ/Ёц | 0 | 20 | 40 | 60 | 80 | 100 |
ШмНтЖШ/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
ЃЈ1ЃЉЙ§ГЬiбаФЅЗлЫщЕФФПЕФЪЧ_______ЁЃ
ЃЈ2ЃЉЙ§ГЬiiМгШызуСПNaOHШмвКЕФзїгУЪЧ______ЁЃ
ЃЈ3ЃЉЙ§ГЬiiiВЩгУВЛЭЌбѕЛЏМСЗжБ№НјааЪЕбщЃЌОљВЩгУLiКЌСПЮЊ3.7%ЕФдСЯЃЌПижЦpHЮЊ3.5ЃЌНўШЁ1.5hКѓЃЌЪЕбщНсЙћШчЯТБэЫљЪОЃК
ађКХ | Ыс | бѕЛЏМС | НўГівКLi+ХЈЖШ(g/L) | ТЫдќжаLiКЌСП/% |
ЪЕбщ1 | HCl | H2O2 | 9.02 | 0.10 |
ЪЕбщ2 | HCl | NaClO3 | 9.05 | 0.08 |
ЪЕбщ3 | HCl | O2 | 7.05 | 0.93 |
ЂйЪЕбщ2жаЃЌNaClO3гыбЮЫсЗДгІЩњГЩЛЦТЬЩЋЦјЬхЃЌДѓДѓдіМгСЫЫсКЭбѕЛЏМСЕФгУСПЃЌИУЗДгІЕФРызгЗНГЬЪНЮЊ______ЁЃ
ЂкНсКЯЪЕбщНсЙћКЭЂйжаЕФЯжЯѓЃЌзюжебЁдёH2O2зїЮЊбѕЛЏМСЃЌдвђЪЧ______ЁЃ
ЂлЙ§ГЬiiiЕУЕНЕФНўГівКбЛЗСНДЮЕФФПЕФЪЧ_____ЁЃ
ЃЈ4ЃЉНўГівКжаДцдкДѓСПH2PO4КЭHPO42ЃЌвбжЊЃКH2PO4 HPO42 +H+ЃЌHPO42 PO43+H+ЃЌНсКЯЦНКтвЦЖЏдРэЃЌНтЪЭЙ§ГЬivЕУЕНСзЫсЬњОЇЬхЕФдвђ_____ЁЃ
ЃЈ5ЃЉЖдБШЙ§ГЬivКЭvЃЌЫЕУїЙ§ГЬivВЛгУБЅКЭNa2CO3ШмвКЕФдвђ______ЁЃ
ЃЈ6ЃЉМђЪіЙ§ГЬviЕФВйзї_______ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЗМЯузхЛЏКЯЮяAЃЈC9H12OЃЉГЃгУгквЉЮяМАЯуСЯЕФКЯГЩЃЌAгаШчЯТзЊЛЏЙиЯЕЃК

ЂйAВЛФмЪЙЫсадИпУЬЫсМиШмвКЭЪЩЋ
Ђк +CO2
+CO2
Ђл![]()
![]()
![]()
ЛиД№ЯТСаЮЪЬт:
ЃЈ1ЃЉAЩњГЩBЕФЗДгІРраЭЮЊ__________ЃЌгЩEЩњГЩFЕФЗДгІЬѕМўЮЊ_________________ЁЃ
ЃЈ2ЃЉDжаКЌгаЕФЙйФмЭХУћГЦЮЊ_________________ЁЃ
ЃЈ3ЃЉKЕФНсЙЙМђЪНЮЊ______________________ЁЃ
ЃЈ4ЃЉFгывјАБШмвКЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_____________________ЁЃ
ЃЈ5ЃЉFгаЖржжЭЌЗжвьЙЙЬхЃЌЗћКЯЯТСаЬѕМўЕФЭЌЗжвьЙЙЬхга____________жжЁЃ
ЂйФмЗЂЩњЫЎНтКЭвјОЕЗДгІ
ЂкЪєгкЗМЯузхЛЏКЯЮяЧвЗжзгжажЛгавЛИіМзЛљ
ЂлОпга5зщКЫДХЙВеёЧтЦзЗх
ЃЈ6ЃЉПЗВцБћЭЊЃЈ ЃЉЪЧвЛжжживЊвНвЉжаМфЬхЃЌВЮПМЩЯЪіКЯГЩТЗЯпЃЌЩшМЦвЛЬѕгЩЪхЖЁДМЃЈ(CH3)3COHЃЉКЭПЗШЉЃЈ
ЃЉЪЧвЛжжживЊвНвЉжаМфЬхЃЌВЮПМЩЯЪіКЯГЩТЗЯпЃЌЩшМЦвЛЬѕгЩЪхЖЁДМЃЈ(CH3)3COHЃЉКЭПЗШЉЃЈ ЃЉЮЊдСЯжЦБИПЗВцБћЭЊЕФКЯГЩТЗЯпЃЈЮоЛњЪдМСШЮбЁЃЌгУНсЙЙМђЪНБэЪОгаЛњЮяЃЌгУМ§ЭЗБэЪОзЊЛЏЙиЯЕЃЌМ§ЭЗЩЯзЂУїЗДгІЪдМСКЭЬѕМўЃЉ___ЁЃ
ЃЉЮЊдСЯжЦБИПЗВцБћЭЊЕФКЯГЩТЗЯпЃЈЮоЛњЪдМСШЮбЁЃЌгУНсЙЙМђЪНБэЪОгаЛњЮяЃЌгУМ§ЭЗБэЪОзЊЛЏЙиЯЕЃЌМ§ЭЗЩЯзЂУїЗДгІЪдМСКЭЬѕМўЃЉ___ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЪвгУИпУЬЫсМиКЭХЈбЮЫсжЦШЁТШЦјЃЌЗДгІЗНГЬЪНШчЯТЃК
[___]KMnO4+[___]HClЃЈХЈЃЉЁњ[___]KCl+[___]MnCl2+[___]Cl2+[___]H2O
ЃЈ1ЃЉХфЦНЩЯЪіЗДгІЕФЛЏбЇЗНГЬЪНЃЌВЂгУЕЅЯпЧХБъГіЕчзгзЊвЦЗНЯђКЭЪ§ФПЁЃ__________
ЃЈ2ЃЉЗДгІжаЃЌHCl ЬхЯжЕФЛЏбЇаджЪЮЊ____ЁЃ
ЃЈ3ЃЉШєЗДгІЯћКФ 2molHClЃЌзЊвЦЕчзгЪ§ФПЮЊ_____ИіЁЃ
ЃЈ4ЃЉНЋSO2ЦјЬхЭЈШыKMnO4ШмвКжаЃЌШмвКЭЪЩЋЃЌЩњГЩMn2+ЃЎаДГіЗЂЩњЗДгІЕФРызгЗНГЬЪН________ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com