
【题目】新能源汽车的核心部件是锂离子电池,常用磷酸亚铁锂(LiFePO4)做电极材料。对LiFePO4废旧电极(含杂质Al、石墨粉)回收并获得高纯Li2CO3的工业流程图如下:

资料:碳酸锂在水中溶解度:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
(1)过程i研磨粉碎的目的是_______。
(2)过程ii加入足量NaOH溶液的作用是______。
(3)过程iii采用不同氧化剂分别进行实验,均采用Li含量为3.7%的原料,控制pH为3.5,浸取1.5h后,实验结果如下表所示:
序号 | 酸 | 氧化剂 | 浸出液Li+浓度(g/L) | 滤渣中Li含量/% |
实验1 | HCl | H2O2 | 9.02 | 0.10 |
实验2 | HCl | NaClO3 | 9.05 | 0.08 |
实验3 | HCl | O2 | 7.05 | 0.93 |
①实验2中,NaClO3与盐酸反应生成黄绿色气体,大大增加了酸和氧化剂的用量,该反应的离子方程式为______。
②结合实验结果和①中的现象,最终选择H2O2作为氧化剂,原因是______。
③过程iii得到的浸出液循环两次的目的是_____。
(4)浸出液中存在大量H2PO4和HPO42,已知:H2PO4 HPO42 +H+,HPO42 PO43+H+,结合平衡移动原理,解释过程iv得到磷酸铁晶体的原因_____。
(5)对比过程iv和v,说明过程iv不用饱和Na2CO3溶液的原因______。
(6)简述过程vi的操作_______。
【答案】增大接触面积,加快反应速率 溶解Al,使其分离出去 ClO3+5Cl+6H+ =3Cl2↑+3H2O Li+的浸出率较高,且较环保(节约酸和氧化剂的用量) 提高浸出液中Li+ 浓度(或提高氧化剂和酸的利用率/节约后续纯碱的用量) CO32结合H+,c(H+)减小,H2PO4![]() HPO42 +H+,HPO42
HPO42 +H+,HPO42![]() PO43+H+,两个电离平衡均向右移动,c(PO43)增大,与Fe3+结合形成磷酸铁晶体 过程iv若使用饱和Na2CO3溶液,其中c(CO32)较大,易形成Li2CO3沉淀与磷酸铁沉淀一同析出,减少高纯Li2CO3的产量 用热水洗涤,干燥
PO43+H+,两个电离平衡均向右移动,c(PO43)增大,与Fe3+结合形成磷酸铁晶体 过程iv若使用饱和Na2CO3溶液,其中c(CO32)较大,易形成Li2CO3沉淀与磷酸铁沉淀一同析出,减少高纯Li2CO3的产量 用热水洗涤,干燥
【解析】
(1)根据影响反应速率的因素分析过程i研磨粉碎的目的;
(2)根据铝可溶于氢氧化钠溶液分析;
(3)①实验2中,NaClO3与盐酸发生归中反应反应生成氯气、氯化钠、水;
②实验1与实验3比,浸出液中Li+浓度高;
③浸出液循环利用,可以提高氧化剂和酸的利用率;
(4)过程iv加入30%的Na2CO3溶液可以提高PO43的浓度;
(5)c(CO32)越大越易生成Li2CO3沉淀;
(6)根据温度越高碳酸锂溶解度越小分析;
(1)过程i研磨粉碎的目的是增大接触面积,加快反应速率;
(2)单质铝可溶于氢氧化钠溶液生成偏铝酸钠,所以过程ii加入足量NaOH溶液的作用是溶解Al,使其分离出去;
(3)①实验2中,NaClO3与盐酸发生归中反应生成氯气、氯化钠、水,反应离子方程式是ClO3+5Cl+6H+=3Cl2↑+3H2O;
②实验2生成氯气污染空气,增加了酸和氧化剂的用量,实验1与实验3比,Li+的浸出率较高,所以最终选择H2O2作为氧化剂;
③过程iii得到的浸出液循环两次的目的是提高氧化剂和酸的利用率,提高浸出液中Li+浓度;
(4)过程iv加入30%的Na2CO3溶液,CO32结合H+,c(H+)减小,H2PO4![]() HPO42+H+,HPO42
HPO42+H+,HPO42![]() PO43+H+,两个电离平衡均向右移动,c(PO43)增大,与Fe3+结合形成磷酸铁晶体;
PO43+H+,两个电离平衡均向右移动,c(PO43)增大,与Fe3+结合形成磷酸铁晶体;
(5)过程iv若使用饱和Na2CO3溶液,其中c(CO32-)较大,易形成Li2CO3沉淀与磷酸铁沉淀一同析出,减少高纯Li2CO3的产量,所以过程iv不用饱和Na2CO3溶液;
(6)温度越高碳酸锂溶解度越小,过程vi的操作是用热水洗涤,干燥。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】(1)在恒温恒容装置中进行合成氨反应(正反应为放热反应),各组分浓度—时间图象如下。

①表示N2浓度变化的曲线是____(填序号)。
②前25 min内,用H2浓度变化表示的化学反应速率是____。该温度下该反应的平衡常数为____。
(2)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是____(填序号)。
a.气体体积不再变化,则已平衡
b.气体密度不再变化,则已平衡
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,往装置中通入一定量Ar,平衡不移动
(3)电厂烟气脱氮:主反应为①4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ΔH<0,副反应为②2NH3(g)+8NO(g)
5N2(g)+6H2O(g) ΔH<0,副反应为②2NH3(g)+8NO(g)![]() 5N2O(g)+3H2O(g) ΔH>0,平衡混合气中N2与N2O含量与温度的关系如图所示。
5N2O(g)+3H2O(g) ΔH>0,平衡混合气中N2与N2O含量与温度的关系如图所示。

请回答:在400~600 K时,平衡混合气中N2含量随温度的变化规律是____________________,导致这种规律的原因是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种气体都能对大气造成污染,在工业上都可以用碱液吸收。已知X是化石燃料燃烧产物之一,是形成酸雨的主要物质;Y是一种单质,它的水溶液具有漂白作用;Z是硝酸工业和汽车尾气中的有害物质之一,能与水反应。请写出下列物质反应的化学方程式。
(1)X在一定条件下与氧气反应____________________________________;
(2)Y与氢氧化钠溶液的反应______________________________________;
(3)Z与水的反应________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物与生产、生活、生命和环境息息相关。
(1)NO加速臭氧层被破坏,其反应过程如图所示。
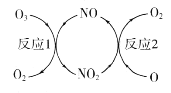
①NO的作用是________________________。
②已知:O3(g)+O(g) =2O2(g) △H=-143kJ·mol-1
反应l:O3(g)+NO(g) =NO2(g)+O2(g)△H1=-200.2kJ·mol-1
则反应2的热化学方程式为____________________________。
(2)肌红蛋白(Mb)是肌肉内储存氧的蛋白质,构成肌红蛋白的甘氨酸(H2NCH2COOH)是一种两性物质,在溶液中以三种离子形式存在,其转化关系如下 三种离子的物质的量分数(δ)与[
三种离子的物质的量分数(δ)与[![]() ]的关系如图所示。
]的关系如图所示。
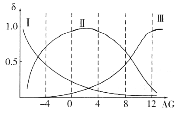
①溶液呈中性时,三种离子浓度由大到小的顺序为______________________。
②向AG=12的溶液中加入过量NaOH溶液时,主要反应的离子方程式为______________。
(3)肌红蛋白(Mb)可与O2结合生成MbO2:![]() 。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
。37℃时测得肌红蛋白的结合度(α)与p(O2)的关系如下表。
[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的物质的量分数]
p(O2)/kPa | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2)% | 50.0 | 66.7 | 80.0 | 85.7 | 88.9 | 90.9 | 92.3 |
①计算37℃时,上述反应的平衡常数K=__________kPa-1(气体和溶液中的溶质分别用分压和物质的量浓度表示)。
②37℃时,若空气中氧气分压为21.0 kPa,则人正常呼吸时α的最大值为________%(保留1位小数)。
③温度不变时,游客在山顶时体内MbO2的浓度比在山下________(填“高”或“低”)。
④研究发现,v正=k正·c(Mb)·p(O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探索二氧化碳在海洋中转移和归宿,是当今海洋科学研究的前沿领域。研究表明,溶于海水的二氧化碳主要以无机碳形式存在,其中HCO3-占95%。科学家利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。

下列说法不正确的是
A. a室中OH-在电极板上被氧化
B. b室发生反应的离子方程式为:H+ + HCO3- = CO2↑ + H2O
C. 电路中每有0.2mol 电子通过时,就有0.2mol阳离子从c室移至b室
D. 若用氢氧燃料电池供电,则电池负极可能发生的反应为:H2 + 2OH- - 2e- =2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制氢气的一个重要反应是:CO(g) +H2O(g)== CO2(g)+H2(g)。
已知在25℃时:
①C(s)+![]() O2(g)
O2(g)![]() CO(g) ΔH1=111kJ·mol 1
CO(g) ΔH1=111kJ·mol 1
②H2(g)+![]() O2(g)== H2O(g) ΔH2=242kJ·mol 1
O2(g)== H2O(g) ΔH2=242kJ·mol 1
③C(s)+O2(g) == CO2(g) ΔH3=394kJ·mol 1
下列说法不正确的是
A. 25℃时,CO(g)+H2O(g)==CO2(g)+H2(g) ΔH=41kJ·mol1
B. 增大压强,反应①的平衡向逆反应方向移动,平衡常数K减小
C. 反应①达到平衡时,每生成1molCO的同时生成0.5molO2
D. 反应②断开2molH2和1molO2中的化学键所吸收的能量比形成4molO-H键所放出的能量少484kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为 A、B 元素的原子结构示意图。下列说法错误的是( )

A.B 的原子结构示意图中 x 为 12
B.A 和 B 分别属于非金属元素和金属元素
C.A 的原子和 B 的原子分别形成简单离子的过程相同
D.A 与 B 可组成化学式为 BA2 的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国内某科技研究小组首次提出一种新型的Li+电池体系,原理示意图如下。该体系正极采用含有I-、Li+的水溶液,负极采用固体有机聚合物,电解质溶液采用LiNO3溶液,聚合物阳离子交换膜作为隔膜将液态正极和固态负极分隔开(已知![]() 在水溶液中呈黄色)。下列有关判断正确的是
在水溶液中呈黄色)。下列有关判断正确的是
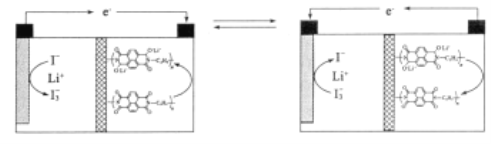
A. 左图是原电池工作原理图
B. 放电时,Li+从右向左通过聚合物离子交换膜
C. 放电时,正极区电解质溶液的颜色变深
D. 充电时,阴极的电极反应式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法正确的是

A. 曲线a表示Fe(OH)2饱和溶液中的变化关系
B. 除去CuSO4溶液中含有的少量Fe2+,可加入适CuO
C. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+):c(Cu2+)=104.6 :1
D. 向X点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com